题目内容
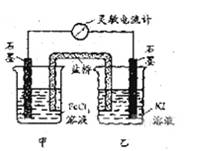
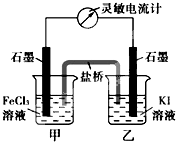 控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )分析:根据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,并利用平衡移动来分析解答.
解答:解:A.当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,故A错误;
B.由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故B正确;
C.当电流计为零时,说明没有电子发生转移,则反应达到平衡,故C正确;
D.因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,故D正确;
故选A.
B.由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故B正确;
C.当电流计为零时,说明没有电子发生转移,则反应达到平衡,故C正确;
D.因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,故D正确;
故选A.
点评:本题是对原电池原理综合考查,并注重与化学平衡的联系,学生明确原电池的工作原理、正负极的判断方法、化学平衡的移动即可解答.

练习册系列答案
相关题目
 I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是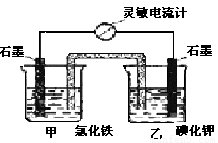
 B 电流计读数为零时,反应达到化学平衡状态
B 电流计读数为零时,反应达到化学平衡状态 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是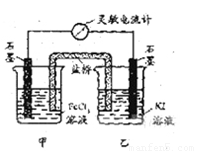

 I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是
I2+2 Fe2+设计成如图所示的原电池。下列判断不正确的是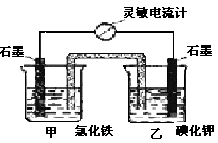
 A 反应从正向开始时,乙中石墨电极上发生氧化反应
A 反应从正向开始时,乙中石墨电极上发生氧化反应