题目内容
哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式: 。检验氨气已装满的方法是:用_____________试纸靠近集气瓶口,现象为_________________。
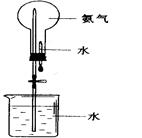
(2)用图装置进行喷泉实验, 若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂 。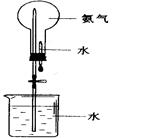
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+ O2="==4NO" + 6 ,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:
4NO+ O2+2H2O="==" 4HNO3
NO2+ O2 + H2O="==" 4HNO3
(4)1.28 gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为 mol.
(1)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O 红色石蕊 试纸变蓝
CaCl2 + 2NH3↑ + 2H2O 红色石蕊 试纸变蓝
(2) 石蕊 (3)5 H2O ; 3 ;4 1 2 (4)0.01
解析试题分析:(1)实验室由氯化铵和熟石灰加热制取氨气的化学方程式是2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
CaCl2 + 2NH3↑ + 2H2O。氨气是一种碱性气体,溶于水显碱性,所以可用用湿润的红色石蕊试纸靠近集气瓶口,而现象则是试纸变为蓝色。
(2)碱液能使紫色的石蕊试纸变为蓝色,所以若要得到蓝色喷泉呢,应加入酸碱指示剂石蕊试液。
(3)根据原子守恒可知,另外一种生成物应该是水。在反应中氮元素的化合价由-3价升高到+2价,失去5个电子,而氧元素的化合价从0价降低到-2价,得到2个电子,所以根据电子的得失守恒可知,配平后的方程式是4NH3+5O2="==4NO" + 6H2O;同样分析可知,另外两个反应的化学方程式分别是4NO+3O2+2H2O=4HNO3、4NO2+O2 +2H2O=4HNO3。
(4)浓硝酸的还原产物是NO2,和氧气混合溶于水后又生成硝酸,所以在反应中铜失去的电子相当于被氧气得到。所以根据电子的得失守恒可知,需要氧气的物质的量是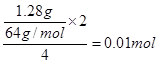 。
。
考点:考查氨气的制备、性质、氧化还原反应方程式的配平以及计算
点评:该题是中等难度的试题,试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练。有利于培养学生的逻辑推理能力和创新思维能力。氧化还原反应的有关配平和计算的关键是准确判断出有关元素的化合价变化情况,然后根据电子的得失守恒即可得出正确的结论。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案