题目内容
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E是一种非金属元素 | B.在ECln中E与Cl之间形成共价键 |
| C.E的一种常见氧化物为EO | D.E位于元素周期表的ⅥA族 |
C
解析试题分析:氯化物ECln的熔点为-78℃,沸点为59℃,常温下为液态,熔沸点较低是分子;由ECln+ nAgNO3===nAgCl↓+E(NO3)2,0.2molECln得到0.2n mol 即57.4g的AgCl沉淀,n=2,E不可能是金属,因为金属氯化物常温下都是固体,故E是非金属,只能是SCl2。故C不正确,S的氧化物为SO2或SO3。
考点:化学方程式计算与短周期元素推断。

练习册系列答案
相关题目
下列说法中正确的是
| A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g |
下列表述正确的是
A.羟基的电子式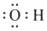 | B.醛基的结构简式—COH |
C.1-丁烯的键线式 | D.聚丙烯的结构简式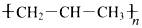 |
阿伏加德罗常数约为6.02×1023 mol-1,下列说法中正确的是
| A.4 g重水(D2O)中所含质子数为0.2×6.02×1023 |
| B.4.48 L N2与CO的混合物所含分子数为0.2×6.02×1023 |
| C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2×6.02×1023 |
| D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2×6.02×1023 |
下列化学用语表示正确的是
| A.高氯酸的化学式:HClO3 | B.氮气的电子式: |
C.氟原子结构示意图: | D.乙烯的结构简式:CH2CH2 |
下列化学用语表示正确的是
| A.原子核中有6个中子的硼原子:6B | B.HCl的电子式: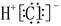 |
C.K+结构示意图: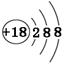 | D.HClO的结构式:H—O—Cl |
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:  | B.COS的电子式是 |
| C.次氯酸的结构式为 H-Cl-O | D. O2-离子结构示意图: O2-离子结构示意图: |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.1mol Na与乙醇完全反应,失去2nA电子 |
| B.常温常压下,10gCH4含有10nA个电子 |
| C.1L 0.1mol?L-1的醋酸溶液中含有0.1nA个H+ |
| D.标准状况下,22.4L苯含有nA个苯分子 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1L0.1mol·L-1的氨水中有NA个NH4+ |
| B.常温常压下,8gO2含有4NA个电子 |
| C.标准状况下,22.4L三氯甲烷含有NA个分子 |
| D.1molNa被完全氧化生成Na2O2,失去2NA电子 |