题目内容
【题目】某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是_______________。
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
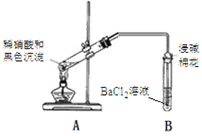
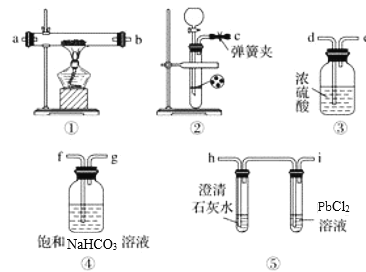
实验装置 | 现象 |
| 1. A试管中黑色沉淀逐渐溶解 |
①现象2说明黑色沉淀具有______性。
②能确认黑色沉淀中含有S元素的现象是_________,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是___________________。
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是_____________。
【答案】黑色沉淀中不含有CuO 还原 B试管中出现白色沉淀 2NO3-+3SO2 + 3Ba2+ + 2H2O = 3BaSO4↓+ 2NO↑+ 4H+;(或NO2 + SO2 + Ba2+ + H2O = BaSO4↓+ NO↑+ 2H+) ③取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物 CuS + 4H2SO4(浓)![]() CuSO4 + 4SO2↑+ 4H2O
CuSO4 + 4SO2↑+ 4H2O
【解析】
(1)根据题中信息中检验铜离子的方法对②进行分析,然后得出正确结论;
(2)①红棕色气体为二氧化氮,说明稀硝酸被还原生成一氧化氮,黑色固体具有还原性;②根据反应现象③可知黑色固体与稀硝酸反应生成了二氧化硫,证明黑色固体中含有硫元素;二氧化氮、二氧化硫的混合气体能够与氯化钡反应生成硫酸钡沉淀,据此写出反应的离子方程式;
③还需要确定黑色固体中含有铜离子;
(3)浓硫酸具有强氧化性,能够将硫化铜中硫氧化成硫酸铜、二氧化硫和水,据此写出反应的化学方程式。
(1)结合题给信息进行分析,将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀,实验证明该黑色固体中不含有CuO;
(2)①A试管内上方出现红棕色气体,说明硝酸的还原产物为一氧化氮,遇到空气生成二氧化氮,证明在黑色固体中含有还原性的物质;
②A中产生的气体通入B中,在B试管中出现白色沉淀,证明白色沉淀是BaSO4,则黑色固体中含有S元素;相应的离子方程式是2NO3-+3SO2 + 3Ba2+ + 2H2O = 3BaSO4↓+ 2NO↑+ 4H+或NO2 + SO2 + Ba2+ + H2O = BaSO4↓+ NO↑+ 2H+,错误;
③ 为确认黑色沉淀是“铜的硫化物”,还应该检验反应后的溶液中还存在Cu2+。故还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物;
(3)CuS与浓硫酸反应的化学方程式是CuS + 4H2SO4(浓)![]() CuSO4 + 4SO2↑+ 4H2O。
CuSO4 + 4SO2↑+ 4H2O。

【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。下表为元素有关信息:
元素 | 信息 |
B | 其单质在常温下为双原子分子,与A可形成分子X,且X的水溶液呈碱性 |
D | 其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的 |
E | 元素原子最外层比次外层少2个电子 |
C、F | 两种元素的原子最外层共有13个电子 |
回答下列问题:
(1)B的原子结构示意图为__,且在周期表中的位置为___。
(2)写出BA3气体验满的方法__。
(3)F的单质在氧化还原反应中常做__剂,该单质与E的低价氧化物1:1通入水中,发生反应的离子方程式为__。
(4)C、D形成的化合物的化学式为__,此物质对应的水化物决定了在物质的分类中应属于__。