题目内容
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
(4)若平衡时H2和HCl的物质的量之比为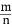 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 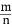 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
 Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
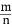 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 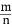 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(1)0.24mol 0. 02  (2)bd (3)ac (4)<
(2)bd (3)ac (4)<
 (2)bd (3)ac (4)<
(2)bd (3)ac (4)< 试题分析:(1)2.80/(3*28+4*14)*3*4=0.24mol;
2.80/(3*28+4*14)*6/3/2="0.02" mol/(L·min);
平衡常数是指可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比;
(2)a、温度不变,加压或改变反应物的浓度等平衡常数不变,错误;b、因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,正确;c、其他条件不变,增加固体Si3N4平衡不移动,错误;d、其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。)
(3)利用化学反应速率之比等于化学方程式计量系数比可知a项叙述表示v正=v逆,表示反应达到平衡态,正确;b项均表示正反应,无论反应是否处于平衡态,都成立,错误;c、混合气体密度不变说明溶液中气体质量不变,而平衡移动则气体质量改变,所以c项表示达到平衡态,正确;d项表示的浓度关系与是否平衡无关,错误。
(4)降低温度,平衡正向移动,n(H2)/n(HCl)变小。

练习册系列答案
相关题目
 2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1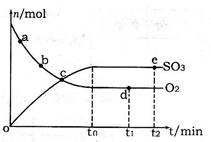
 cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是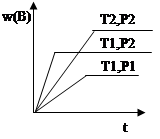
 CH3OH(g)
CH3OH(g)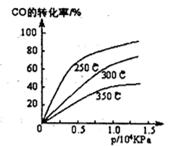
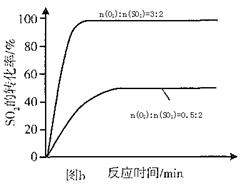
 2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
 2NH3。
2NH3。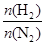 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )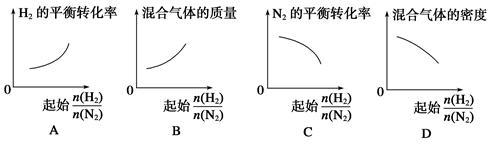
 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )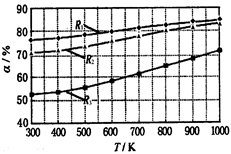
 2NO2中通入18O组成的氧气,重新达到平衡后,则18O
2NO2中通入18O组成的氧气,重新达到平衡后,则18O nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )