��Ŀ����
����Ŀ��ÿ������������������Ű���ȵ��������У�ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
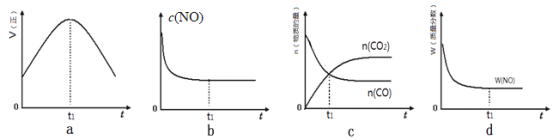
(l)����β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����________________������ţ���
2CO2(g)+N2(g)��H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����________________������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol ��
2NO2(g)![]() N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol ��
H2O(g)��H2O(l) ��H����44.0 kJ/mol ��
д��CH4����ԭN2O4(g)����N2��H2O��l�����Ȼ�ѧ����ʽ__________________��
��3������ȼ�ϵ�ؿ����������������ʡ�
�ټ��Խ����м���ȼ�ϵ�صĸ�����Ӧʽ_________________________��
�������·����0.1mol����ͨ�������������ı�״�������������Ϊ_______��
��4����֪ȼ�ϵ�صı������뵥λ������ȼ��ʧȥ�ĵ����������ȡ������ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳����_________��
���𰸡� bd CH4(g)+ N2O4(g)��N2(g)��CO2(g)+2H2O(l)�ġ�H����898.1 kJ/mol CH4-8e��+10OH����CO32��+7H2O 0.56L ���������顢�״�
��������
��1����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬����
a������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬a����
b��NO��Ũ�����ŷ�Ӧ�Ľ�����С���ﵽ��ѧƽ���NO��Ũ�Ȳ��ٷ����仯��b��ȷ��
c��t1ʱ�̺�CO2��CO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬��c����
d��t1ʱ��NO����������Ϊ��ֵ��˵��NO��Ũ�ȡ��ٷֺ������ٱ仯����t1ʱ���Ѿ��ﵽƽ��״̬��d��ȷ��
��ѡbd��
��2����֪��
CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g) ��H����867 kJ/mol ��
2NO2(g)![]() N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol ��
H2O(g)��H2O(l) ��H����44.0 kJ/mol ��
���ݸ�˹���ɣ���-��+�ۡ�2�ɵ÷�ӦCH4(g)+N2O4(g)��N2(g)��CO2(g)+2H2O(l)�ġ�H����898.1 kJ/mol��
��3����ԭ����и�������������Ӧ�������ڸ���ͨ�룬���������£�����������Ӧ����̼�����ˮ�������缫��ӦʽΪCH4-8e��+10OH����CO32��+7H2O��
��1mol�����õ�4mol���ӣ������·����0.1mol����ͨ��������ݵ��ӵ�ʧ�غ��֪�������������ʵ�����0.1mol��4��0.025mol����״�������������Ϊ0.025mol��22.4L/mol��0.56L��
��4����֪ȼ�ϵ�صı������뵥λ������ȼ��ʧȥ�ĵ����������ȣ������������1g�������������顢�״�ʧȥ���ӵ����ʵ����ֱ���![]() ��
��![]() ��
��![]() ��������Ҫ�����ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳�������������顢�״���
��������Ҫ�����ϣ����������顢�״�ȼ�ϵ�صı������Ӵ�С��˳�������������顢�״���

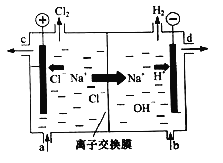
����Ŀ����ʯī�缫������е��ʵ��
ʵ��һ | ʵ��� | |
װ�� |
|
|
���� | a��d����ֽ����;b�����,�ֲ���ɫ;c�������Ա仯 | ����ʯī�缫���������ݲ���;n�������ݲ������� |
���ж�ʵ������Ľ��ͻ��Ʋⲻ�������ǣ� ��
A. a��d����2H2O+2e-=H2��+2OH- B. b����2Cl--2e-=Cl2��
C. c�������˷�Ӧ��Fe-2e-=Fe2+ D. ����ʵ��һ��ԭ��,ʵ�����m��������ͭ
����Ŀ������һƿA��B�Ļ�����֪���ҵ�ijЩ���������ʾ���� ��
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm-3 | ˮ�е��ܽ��� |
A | -75 | 66 | 0.93 | ���� |
B | -66 | 110 | 0.90 | ���� |
�ݴˣ������һ������ķ����ǣ� ��
A.����B.������C.��ȡ��D.���˷�