题目内容
如右下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?)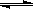 aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
B
解析试题分析:根据三段式: 2X(?) + Y(?) aZ(g)
aZ(g)
起始 2mol 2mol 0
反应 2xmol xmol axmol
平衡 (2-2x)mol (2-x)mol axmol
平衡时X、Y、Z的物质的量之比为1∶3∶2,则x=0.8,a=1。
II中气体的密度随时间增大,II是固定容积的容器,说明反应前后气体的质量增加,则X、Y中只有一种为气态。若X、Y均为气态,I和II起始状态相同,平衡时I中的压强比II中的压强大所以I中X的转化率大于II中X的转化率。若X为固态、Y为气态,该反应为反应前后气体体积不变,I和II起始状态相同,则达平衡时,I和II的状态仍然相同,所以达平衡所需的时间也相同。答案选B。
考点:等效平衡
点评:本题是起始状态相同的恒温恒容容器与恒温恒压容器比较转化率的习题,这也是等效平衡的典型类型。解决这类习题要先让等压容器体积不变,然后再改变体积看平衡移动的方向。

练习册系列答案
相关题目
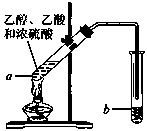
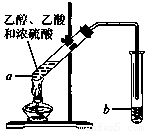
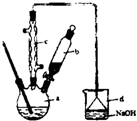 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中(装置如右下图所示)加入15mL无水的苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是
(3)仪器c的作用是冷凝回流,回流的主要物质有
(4)步骤3中第一次用10mL水洗涤的主要操作步骤为
(5)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如左上表,则要进一步提纯粗产品,还必须进行的实验操作名称是
(6)若步骤4的粗产品经进一步精制得到6.5mL的溴苯.则该实验中溴苯的产率是