题目内容
【题目】(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用。

①上图是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:____________________________。(△H的数值用含字母a、b的代数式表示)
②在25°C时,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液显中性,则反应后的溶液中:c(NH4+)_______c(Cl-)(填“>”、“<”或“=”)
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C时,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1的硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是________________,产生该现象的原因是(用离子方程式表示)___________________________。
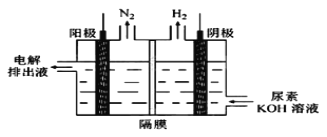
(3)下图为一电化学装置,电极分别为铁棒和碳棒。U形管中盛有电解质溶液。

①若U形管中盛有饱和食盐水,打开K2,闭合K1, 铁棒为_______极,碳棒上的电极反应式为_______________________。
②若U形管中是含Cr2O72-的酸性废水,通过该装置可以除去Cr2O72-离子。闭合K2,打开K1,阳极区所发生的反应有:Fe-2e- =Fe2+和____________________ (写离子反应方程式)
【答案】 N2(g)+3H2(g)![]() 2NH3(g) ΔH=(2a-2b) kJ/mol = 白色沉淀转变为黄色沉淀 AgCl(s)+I-(aq)=AgI(s)+Cl- 阴 2Cl--2e—=Cl2↑ 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
2NH3(g) ΔH=(2a-2b) kJ/mol = 白色沉淀转变为黄色沉淀 AgCl(s)+I-(aq)=AgI(s)+Cl- 阴 2Cl--2e—=Cl2↑ 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】(1)①根据图像可知生成1molNH3过程中放出的能量是(b-a)kJ,则工业合成氨的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=(2a-2b) kJ/mol;②反应后溶液显中性,c(H+)=c(OH-),则根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知反应后的溶液中:c(NH4+)=c(Cl-);(2)碘化银的溶度积常数小于氯化银,则向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是白色沉淀转变为黄色沉淀,反应的离子方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-。(3)①若U形管中盛有饱和食盐水,打开K2,闭合K1, 构成电解池,铁棒与电源的负极相连,为阴极,碳棒是正极,溶液中的氯离子放电,电极反应式为2Cl--2e—=Cl2↑。②闭合K2,打开K1,铁棒与电源正极相连,作阳极,铁失去电子转化为亚铁离子,生成的亚铁离子被Cr2O72-氧化,因此阳极区所发生的反应有:Fe-2e-=Fe2+和6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
2NH3(g) ΔH=(2a-2b) kJ/mol;②反应后溶液显中性,c(H+)=c(OH-),则根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知反应后的溶液中:c(NH4+)=c(Cl-);(2)碘化银的溶度积常数小于氯化银,则向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是白色沉淀转变为黄色沉淀,反应的离子方程式为AgCl(s)+I-(aq)=AgI(s)+Cl-。(3)①若U形管中盛有饱和食盐水,打开K2,闭合K1, 构成电解池,铁棒与电源的负极相连,为阴极,碳棒是正极,溶液中的氯离子放电,电极反应式为2Cl--2e—=Cl2↑。②闭合K2,打开K1,铁棒与电源正极相连,作阳极,铁失去电子转化为亚铁离子,生成的亚铁离子被Cr2O72-氧化,因此阳极区所发生的反应有:Fe-2e-=Fe2+和6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案