题目内容
10.硫酸铝钾是一种复盐,其电离方程式为KAl(SO4)2═K++Al3++2SO42-,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式A.Ba2++SO32-═BaSO4↓
B.Al3++3OH-═Al(OH)3↓
C.Al3++4OH-═AlO2-+2H2O
D.2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
E.Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓
F.Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
请回答:
(1)Al3+完全沉淀时的离子方程式为D.(只选一个填写字母,下同)
(2)SO42-完全沉淀时的离子方程式为F.
(3)沉淀达到最大量时,沉淀的总和为2.5amol,此时的离子方程式为D.
分析 (1)铝离子完全沉淀时,铝离子与氢氧根离子的物质的量之比为1:3,则硫酸铝钾与氢氧化钡的物质的量之比为2:3;
(2)当硫酸根离子完全反应时,硫酸铝钾与氢氧化钡的物质的量之比为1:2,此时铝离子与氢氧根离子的物质的量之比为1:4,氢氧化铝完全溶解;
(3)当铝离子恰好完全沉淀时,生成的沉淀的物质的量最大,据此计算出生成沉淀的最大量.
解答 解:(1)由于溶液中Al3+与SO42-的物质的量之比为1:2,则反应铝离子完全沉淀时,a mol Al3+消耗$\frac{3}{2}$a mol Ba(OH)2,反应的离子方程式为:D.2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,
故答案为:D;
(2)当2a mol SO42-完全沉淀时消耗2amol Ba(OH)2,此时铝离子与氢氧根离子的物质的量之比为1:4,则反应的离子方程式为:F.Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:F;
(3)当铝离子恰好完全反应时生成的沉淀的物质的量最大,发生的反应为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,则生成沉淀的总物质的量为:a amol+$\frac{3}{2}$a mol=2.5amol,
故答案为:2.5a;D.
点评 本题考查了离子方程式书写与计算,题目难度中等,明确发生反应的实质为解答关键,(3)为易错点,注意正确判断生成沉淀的量最大时硫酸铝钾与氢氧化钡的物质的量的关系,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
20.向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO${\;}_{4}^{2-}$的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.25 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后生成的单质为Fe |
1.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是( )

| A. | S(s,单斜)=S(s,正交)△H=+0.33kJ/mol | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量 |
15.在下述条件下,一定能大量共存的离子组是( )
| A. | 强酸性溶液中:ClO-、S2-、SO32-、Na+ | |
| B. | 强碱性溶液中:ClO-、S2-、SO32-、Na+ | |
| C. | 使甲基橙变黄的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42- | |
| D. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- |
2.二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=(a+2b-2c)kJ•mol-1.
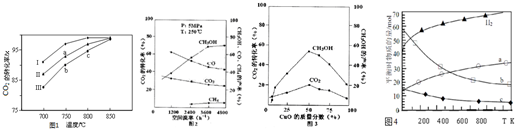
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大.
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
试说明不选择单组份ZnO原因是使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用.
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).

(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=(a+2b-2c)kJ•mol-1.
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示.
①a点所代表的状态不是(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大.
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2?CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为3600h-1;
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) $\stackrel{催化剂}{?}$ C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S<0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=$\frac{p({C}_{2}{H}_{4})×{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})×{p}^{6}({H}_{2})}$.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强;提高氢气和二氧化碳物质的量的比值(列举2项).