题目内容
(2013?徐州模拟)下列有关说法错误的是( )
分析:A.根据△G=△H-T?△S判断;
B.利用牺牲阳极的阴极保护法解答;
C.利用平衡移动的原理解释;
D.降低温度,正逆反应的速率均降低;
B.利用牺牲阳极的阴极保护法解答;
C.利用平衡移动的原理解释;
D.降低温度,正逆反应的速率均降低;
解答:解:A.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行. NH3(g)+HC1(g)=NH4C1(S) 低温下能自发进行,△G=△H-T?△S<0,低温T<0,从方程式知:?△S<0,说明△H<0,故A正确;
B.为保护海轮的船壳,常在船壳上镶入锌块,锌块船壳的成分铁和海水构成原电池,锌比铁活泼,锌作原电池的负极,铁作原电池的正极,所以船身被保护,故B正确;
C.纯碱溶于水中,碳酸钠中弱离子碳酸根的水解导致溶液显碱性,碱性溶液能去除油污,纯碱溶于热水中,去污效果增强,说明溶液碱性增强,即碳酸钠水解程度增大,根据化学平衡移动的原理,升高温度,平衡向吸热的方向移动,所以水解是吸热反应,故C正确;
D.反应N2(g)+3H2(g)=2NH3 (g)(△H<0)达平衡后,降低温度,正逆反应的速率均降低,由于该反应正反应为放热反应,所以,降低温度,平衡向正反应方向移动,故D错误;
故选D.
B.为保护海轮的船壳,常在船壳上镶入锌块,锌块船壳的成分铁和海水构成原电池,锌比铁活泼,锌作原电池的负极,铁作原电池的正极,所以船身被保护,故B正确;
C.纯碱溶于水中,碳酸钠中弱离子碳酸根的水解导致溶液显碱性,碱性溶液能去除油污,纯碱溶于热水中,去污效果增强,说明溶液碱性增强,即碳酸钠水解程度增大,根据化学平衡移动的原理,升高温度,平衡向吸热的方向移动,所以水解是吸热反应,故C正确;
D.反应N2(g)+3H2(g)=2NH3 (g)(△H<0)达平衡后,降低温度,正逆反应的速率均降低,由于该反应正反应为放热反应,所以,降低温度,平衡向正反应方向移动,故D错误;
故选D.
点评:本题较为综合,考查了反应热与焓变、原电池的电化学腐蚀的防护、水解的应用、化学平衡的影响因素,须掌握并能应用相关知识,题目难度中等.

练习册系列答案
相关题目
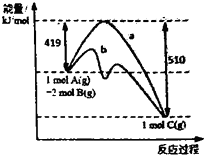 (2013?徐州模拟)反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
(2013?徐州模拟)反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )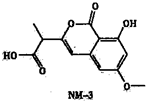 (2013?徐州模拟)NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
(2013?徐州模拟)NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )