题目内容
16.1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则2mol C2H2完全燃烧放出的热量为2589.6kJ;写出C2H2燃烧的热化学方程式:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ/mol.分析 根据1.00g C2H2气体完全燃烧生成液态水和CO2,放出49.8kJ的热量,计算2molC2H2燃烧放出的热量,根据2molC2H2燃烧放出的热量,标注物质聚集状态,写出热化学方程式.
解答 解:1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则2mol C2H2完全燃烧放出的热量=26g/mol×2mol×49.8KJ=2589.6kJ,C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6k J/mol,
故答案为:2589.6;2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6k J/mol.
点评 本题考查热化学方程式、反应热的有关计算、热化学方程式的意义等,注意书写和计算方法的把握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列不能用胶体的有关知识解释的是( )
| A. | 在豆浆中加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 往红褐色的氢氧化铁胶体中加入过量稀盐酸,溶液变黄色 | |
| D. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
7.在溶液中能大量共存而且为无色透明的溶液是( )
| A. | NH4+、Cu2+、SO42-、NO3- | B. | K+、Ca2+、NO3-、CO32- | ||
| C. | Na+、K+、HCO3-、NO3- | D. | K+、MnO4-、NH4+、NO3- |
4.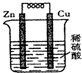 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )
 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 该装置将化学能转化为电能 | D. | 电子由铜片经导线流向锌片 |
11.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法
A.加热
B.滴加碘水
C.加入KSCN溶液
D.通过灼热的CuO.
| 实验目的 | 试剂及方法 |
| 证明地瓜中有淀粉 | B |
| 除去CO2中混有的少量CO | D |
| 检验FeCl2溶液是否变质 | C |
| 除去Na2CO3固体中NaHCO3 | A |
A.加热
B.滴加碘水
C.加入KSCN溶液
D.通过灼热的CuO.
1.工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的左(填写“左”或“右”)池注入.
②图中X是Cl2(填化学式);乙中右室的电极反应式为:O2+4e-+2H2O=4OH-,③图示中氢氧化钠溶液质量分数a%与b%的关系是B(填字母).
A.a%=b% B.a%>b% C.a%<b%
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
下列说法中,不正确的是bcd(填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为:
c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2.无隔膜法电解冷的食盐水相应的离子方程式为Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①经精制的饱和NaCl溶液应从图中电解池的左(填写“左”或“右”)池注入.
②图中X是Cl2(填化学式);乙中右室的电极反应式为:O2+4e-+2H2O=4OH-,③图示中氢氧化钠溶液质量分数a%与b%的关系是B(填字母).
A.a%=b% B.a%>b% C.a%<b%
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为:
c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
8.下列有关物质的结构和性质的叙述中,错误的是( )
| A. | 水分子之间氢键的方向性导致冰中水分子的堆积方式不属于分子密堆积 | |
| B. | 由极性键构成的分子可能是非极性分子 | |
| C. | 水蒸气、水、冰中都含氢键 | |
| D. | 分子晶体中一定存在分子间作用力,可能存在共价键 |
5.下列物质所属类别不正确的是( )
| A. | 氯化铝--盐 | B. | 纯碱--碱 | C. | 金属钠--单质 | D. | 胆矾--纯净物 |
6.下列有关物质用途的叙述错误的是( )
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 煤的气化和液化主要是生成清洁燃料,煤的干馏主要是生产化工原料 |