题目内容
【题目】下列反应的离子方程式中,书写正确的是( )
A. 氢氧化铜与稀硫酸反应:OH-+H+===H2O
B. 铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 氯化铝溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
【答案】D
【解析】氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O,故A错误;铁粉加入稀硫酸中:Fe+2H+===Fe2++H2↑,故B错误;碳酸钙与醋酸反应:CaCO3+2CH3COOH = Ca2++2CH3COO-+CO2↑+H2O,故C错误;氢氧化铝难溶于氨水,氯化铝溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确。
,故D正确。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
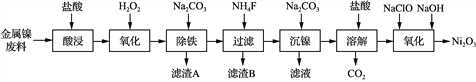
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1) 为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:
①适当升高温度;②搅拌;③________等。
(2) 加入H2O2时发生主要反应的离子方程式为________________。
(3) “除铁”时,控制溶液pH的范围为______________。
(4) 滤渣B的主要成分的化学式为______________。
(5) 已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>________mol·L-1。
(6) “氧化”生成Ni2O3的离子方程式为________________。