题目内容
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K =1.75×10-5
碳酸K1=4. 30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-2
(1)写出碳酸的第一级电离平衡常数的表达式:K1=___。
(2)在相同条件下,试比较CH3COONa、Na2CO3和Na2SO3水溶液的碱性强弱:____>____>___ 。
(3)在相同条件下,试比较同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中粒子的数目:____。
(4)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是___(填序号)。
A.c(CH3COO -)
B.c(H+)
C.醋酸电离平衡常数
D.醋酸的电离程度
Ⅱ,某化工,一废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol.L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
醋酸K =1.75×10-5
碳酸K1=4. 30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-2
(1)写出碳酸的第一级电离平衡常数的表达式:K1=___。
(2)在相同条件下,试比较CH3COONa、Na2CO3和Na2SO3水溶液的碱性强弱:____>____>___ 。
(3)在相同条件下,试比较同浓度同体积H2SO3、NaHSO3和Na2SO3溶液中粒子的数目:____。
(4)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是___(填序号)。
A.c(CH3COO -)
B.c(H+)
C.醋酸电离平衡常数
D.醋酸的电离程度
Ⅱ,某化工,一废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol.L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:

(5)你认为往废水中投入____(填字母序号),沉淀效果最好。
A. NaOH
B.Na2S
C.KI
D.Ca(OH)2
(6)如果用食盐处理只含有重金属Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(密度约为 1 g.mL-1)。若环境要求排放标准为c(Ag+)低于1.0×10-8 mol.L-1,问该工厂处理后的废水中c(Ag+)= _____[已知:Ksp(AgCl) =1.8×10-10]。
A. NaOH
B.Na2S
C.KI
D.Ca(OH)2
(6)如果用食盐处理只含有重金属Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(密度约为 1 g.mL-1)。若环境要求排放标准为c(Ag+)低于1.0×10-8 mol.L-1,问该工厂处理后的废水中c(Ag+)= _____[已知:Ksp(AgCl) =1.8×10-10]。
(1)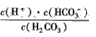
(2)Na2CO3; Na2SO3; CH3COONa
(3)Na2SO3 ;NaHSO3 ;H2SO3
(4)AD
(5)B
(6)9×10 -9 mol . L-1
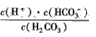
(2)Na2CO3; Na2SO3; CH3COONa
(3)Na2SO3 ;NaHSO3 ;H2SO3
(4)AD
(5)B
(6)9×10 -9 mol . L-1

练习册系列答案
相关题目