题目内容
对相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
| A.若质量相等,则质子数相等 | B.若原子数相等,则中子数相等 |
| C.若分子数相等,则体积相等 | D.若体积相等,则密度相等 |
C
解析试题分析:12C18O和14N2分子的质量数分别为30、28,质子数均为14,中子数分别为16、14,所以若12C18O和14N2 气体的质量相同,但摩尔质量不同,所以质子数不等,A错误;二者都是双原子分子,所以若原子数相等,比较单个分子含有的中子数,不等,所以B错误;因为两气体在相同状况下,体积之比等于分子数之比,所以若分子数相等,则体积相等,C正确;当体积相等时,二者物质的量相等,但质量不等,所以密度不等,D错误;故选C。
考点:本题考查的是物质结构和阿伏伽德罗定律的应用。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案阿佛加德罗常数用NA表示,下列叙述正确的是( )
| A.室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ |
| B.常温常压下,46g NO2含有的原子数小于3NA |
| C.12g石墨含有4NA个自由移动的电子 |
| D.1mol LiAlH4在125℃完全分解成LiH、H2、Al,转移电子3NA |
下列化学用语正确的是
A.NH4Cl的电子式: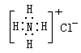 |
B.S2—的结构示意图: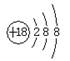 |
| C.乙醇的分子式:CH3CH2OH |
D.原子核内有8个中子的碳原子: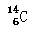 |
NA为阿伏加德罗常数,下列各项叙述中,正确的有
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③0.1 mol FeCl3滴入沸水形成的胶体粒子的数目为0.1 NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
| A.①②③ | B.①②④ | C.①②③④ | D.②④ |
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.②⑤ | B.②③⑥ | C.①⑤⑥ | D.③⑥ |
某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为
| A.0.15mol/L | B.0.3mol/L | C.0.225mol/L | D.无法计算 |
相同物质的量的N2和CO两者相比较,下列说法不正确的是
| A.所占的体积一定相等 | B.所含原子总数相等 |
| C.所含电子总数相等 | D.所含分子数相等 |
食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布结构示意图为: |
| B.纯碱与汽油去除油污的原理相同 |
C.“84消毒液”中有效成分NaClO的电子式为: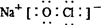 |
| D.蔗糖与醋酸的最简式相同 |
在标准状况下,相同体积的H2、O2、N2三种气体,有关叙述正确的是
| A.分子数相同 | B.质量相同 | C.原子数相同 | D.密度相同 |