题目内容
下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。
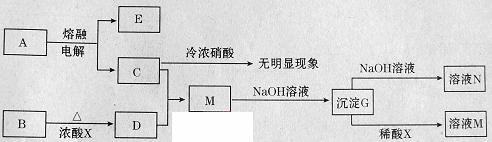
请回答:
(1)指出A中存在的化学键类型: 。
(2)写出M与过量氨水反应的离子方程式: 。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________ ________。
(4)电解熔融氧化物A,阳极的电极反应方程式为 。
(5)B与浓酸X反应的化学方程式为 。
(6)能不能直接蒸发溶液M得到M晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(1) 离子键
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)通入过量CO2气体有白色沉淀生成;加入过量稀盐酸有气体产生,沉淀溶解
(4)2O2-—4e-=O2↑
(5)MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(6)不能 应在HCl气流中加热蒸发结晶
【解析】电解熔融氧化物A得到固体单质C,且C遇冷浓硝酸无现象,由此可判断C是金属铝,A是Al2O3;D为黄绿色气体,则D是Cl2,通常用MnO2和浓盐酸制Cl2,所以氧化物B是MnO2,浓酸X是浓盐酸,铝与氯气反应得到的M为AlCl3,AlCl3与NaOH溶液反应首先生成Al(OH)3沉淀,然后Al(OH)3溶于NaOH溶液得NaAlO2溶液,即N是NaAlO2。(3)向NaAlO2溶液中通入过量二氧化碳发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,加入过量稀盐酸后发生反应HCO3-+H+=CO2↑+H2O和Al(OH)3+3H+=Al3++H2O,所以反应现象为:通入CO2气体有白色沉淀生成;加入盐酸盐酸有气体产生,沉淀溶解。(6)AlCl3是强酸弱碱盐,在水溶液里易发生水解:AlCl3+3H2O![]() Al(OH)3+3HCl,加热蒸发时HCl挥发,水解平衡右移,所以直接蒸发AlCl3溶液得到的固体是Al(OH)3。
Al(OH)3+3HCl,加热蒸发时HCl挥发,水解平衡右移,所以直接蒸发AlCl3溶液得到的固体是Al(OH)3。




