题目内容
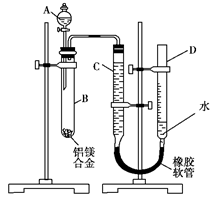
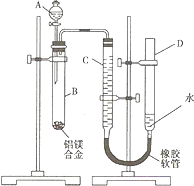 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.A中为NaOH溶液.
(1)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①调节量气管两侧液面相平,并记录C的起始液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂.
上述操作的顺序是______(填序号).
(2)记录C的起始液面位置时,除视线平视外,还应调节量气管两侧液面相平,其原因是______.
(3)B中发生反应的离子方程式为______.
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体质量为Cg,则铝的相对原子质量为______.
(5)实验前,先将铝镁合金在稀盐酸中浸泡片刻,其目的是______.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______(填“偏大“、“偏小“、“不受影响”).
解:(1)实验时首先要检查气密性,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重; 所以顺序为①、④、③、②,
故答案为:①、④、③、②;
(2)量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:保证在常压下测定产生气体的体积;
(3)B管中发生铝与NaOH溶液的反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
所以2bM=(a-c)×3×22400ml
解之得:M=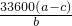 ,
,
故答案为: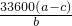 ,
,
(5)实验前先将铝镁合金在稀盐酸中浸泡片刻,目的是除去合金表面的氧化膜,
故答案为:除去合金表面的氧化膜;
(6)铝的质量分数为: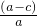 ,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
故答案为:偏小.
分析:(1)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量;
(2)在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(3)B中发生的是Al与碱的反应;
(4)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得;
(5)实验前,先将铝镁合金在稀盐酸中浸泡片刻,除去合金表面的氧化膜;
(6)未洗涤,则造成(a-c)变小,则由(4)的结果可进行判断
点评:本题考查混合物的计算和测定,题目难度中等,建议加强元素化合物的学习,学会分析实验中的每一个关键点.
故答案为:①、④、③、②;
(2)量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:保证在常压下测定产生气体的体积;
(3)B管中发生铝与NaOH溶液的反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
所以2bM=(a-c)×3×22400ml
解之得:M=
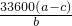 ,
,故答案为:
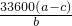 ,
,(5)实验前先将铝镁合金在稀盐酸中浸泡片刻,目的是除去合金表面的氧化膜,
故答案为:除去合金表面的氧化膜;
(6)铝的质量分数为:
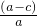 ,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,故答案为:偏小.
分析:(1)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量;
(2)在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(3)B中发生的是Al与碱的反应;
(4)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得;
(5)实验前,先将铝镁合金在稀盐酸中浸泡片刻,除去合金表面的氧化膜;
(6)未洗涤,则造成(a-c)变小,则由(4)的结果可进行判断
点评:本题考查混合物的计算和测定,题目难度中等,建议加强元素化合物的学习,学会分析实验中的每一个关键点.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
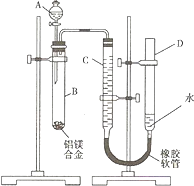 (2008?重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(2008?重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量. 某学习小组用如图装置制取纯净干燥的氯气,并探究其性质
某学习小组用如图装置制取纯净干燥的氯气,并探究其性质 电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )
电化学法可消除甲醇(CH3OH)对水质造成的污染.其原理是:通电后Co2+被氧化成Co3+,生成的Co3+把水中的甲醇氧化:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.某学习小组用如图装置进行实验.下列说法错误的是( )