题目内容
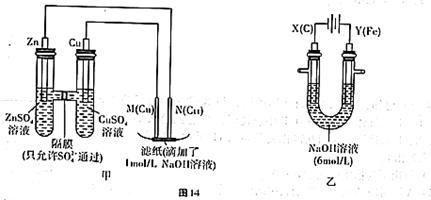
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。


I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象 。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
(1)B (2)从右向左; 滤纸上有蓝色沉淀产生 (3)增大 (4)Fe − 6e−+ 8OH−=FeO42− + 4H2O
(5)168 (6)2FeO42− + 6e− + 5H2O=Fe2O3 + 10OH−
【解析】
试题分析:(1)甲装置是原电池,Zn作负极,Cu作正极。若要保证电极反应不变,则另一个电极的活动性只要比Zn弱即可。根据金属活动性顺序,Mg>Zn,不能是Mg。(2)根据同种电荷相互排斥,异种电荷相互吸引的原则,实验过程中,SO42−会向正电荷较多的Zn电极方向移动。即从右向左移动。此时由于在阳极上发生反应Cu-2e-=Cu2+,产生的Cu2+在溶液中发生反应Cu2++2OH-=Cu(OH)2↓.所以在滤纸上能观察到的现象是有蓝色沉淀产生。(3)由图可知:X为阴极。电解过程中,X极上发生:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离。最终导致溶液的C(OH-)增大,所以溶液的pH增大。(4)根据已知条件可知:在电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和Fe − 6e−+ 8OH−=FeO42− + 4H2O(5)n(H2)=0.672L÷22.4L/mol=0.03mol.n(e-)=0.06mol.在整个电路中电子转移数目相等。4×n(O2)+6×(0.28g÷56g/mol)= 0.06mol。解得n(O2)=0.0075mol.所以V(O2)= 0.0075mol×22.4L/mol= 0.168L =168ml. (6)K2FeO4—Zn也可以组成碱性电池,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2。K2FeO4在电池中作为正极材料,其电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2.用总反应式—负极电极式可得:该电池正极发生的电极反应式为2FeO42− + 6e− + 5H2O=Fe2O3 + 10OH−
考点:考查原电池、电解池的电极反应、离子移动的方向及有关的计算的知识。

 备战中考寒假系列答案
备战中考寒假系列答案