题目内容
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为______;得到滤渣1的主要成分为(填化学式)______.
(2)第②步加H2O2的作用是______,使用H2O2的优点是______;调溶液pH的目的是使______生成沉淀.
(3)用第③步所得CuSO4?5H2O制备无水CuSO4的方法是______.
(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了三种方案:

上述三种方案中,______方案不可行,原因是______:从原子利用率角度考虑,______方案更合理.
解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:(,离子方程式Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;
3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;
故答案为:Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt;
3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+,不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
故答案为:加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙最合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行;从原子利用率和是否产生杂质考虑知,乙方案更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙;
分析:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
点评:本题考查制备硫酸铜和硫酸铝晶体的实验设计,明确离子的性质是解答本题关键,题目难度中等.
 Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;
3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;故答案为:Cu+4H++2NO3-
 Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt;
3Cu2++2NO↑+4H2O;Au、Pt;(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+,不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
故答案为:加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙最合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行;从原子利用率和是否产生杂质考虑知,乙方案更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙;
分析:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
点评:本题考查制备硫酸铜和硫酸铝晶体的实验设计,明确离子的性质是解答本题关键,题目难度中等.

练习册系列答案
相关题目
某混合物粉末可能含有Al、Fe、FeO、Al2O3,某研究小组在实验室积极探究其组成.
(1)研究小组首先排除了含有单质Al的可能性,加入的试剂是______(填序号)
A.硫酸 B.盐酸 C.氨水 D.氢氧化钠溶液
证明不含单质铝的现象是______.
(2)该混合物的组成基本确定为Fe、FeO、Al2O3.请以上述粉末为样品,验证其组成.限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/L盐酸、3% H2O2、3mol/LCuSO4、蒸馏水.
根据你设计的实验方案,在答题卡上按下表的格式写出空白部分的实验操作、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤. | 粉末减少,说明粉末可能含有Al2O3 |
| 步骤2:取少量步骤1的滤液于试管中,逐滴滴加3mol/L盐酸至过量. | ______, 说明粉末中含有Al2O3. |
| 步骤3:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤. | 有红色固体生成,说明粉末中含有______. |
| 步骤4:______ | ______ |


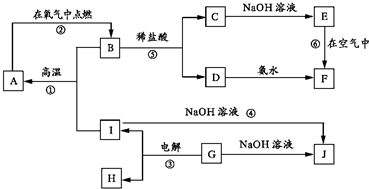 A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀.
A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀. 已知X、Y、Z、W均为中学化学中常见物质,它们之间的转化关系如图(部分产物已略 ).下列说法不正确的是
已知X、Y、Z、W均为中学化学中常见物质,它们之间的转化关系如图(部分产物已略 ).下列说法不正确的是