��Ŀ����
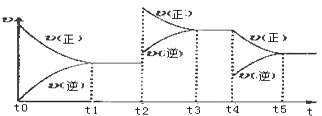
����Ŀ��������CuSO4��NaCl��KNO3��1mol����Һ�ֱ����ڼס��ҡ��������ձ��н��е�⣨�缫��Ϊʯī��������ȣ�����ͼ1��ʾ����ͨ��Դһ��ʱ���b�缫�������ӣ������£������ձ�����Һ��pH��ͨ��ʱ��ı仯��ͼ2��
��1��M��ֱ����Դ�������������������
��2�����ձ����������̪��Һ�������������ȳ��ֺ�ɫ�����c����d����
��3��0��t1���ڣ�e�缫�����ɵ������ڱ�״���µ����ΪL��t1��ʱ���缫b��c��������Ϊg��
��4��t2��ʱ������ֱ����Դ���������Ե������������缫���������ٷ����仯�Ĺ����У�a�缫�漰���ĵ缫��ӦʽΪ �� 
���𰸡�
��1����
��2��d
��3��5.6��32
��4��2H++2e��=H2����Cu2++2e��=Cu
���������⣺��ͨ��Դһ��ʱ���b�缫�������ӣ�Ӧ������������bΪ������aΪ��������֪MΪ������NΪ������c��eΪ������d��f��������1��M��ֱ����Դ�����������Դ��ǣ�������2��cΪ����������������Ӧ����������d�������������ӵõ��Ӳ����������õ缫��������������Ũ�����ӣ���ʾ���ԣ�������̪��ʾ��ɫ�����Դ��ǣ�d����3����ͼ2��֪t1sʱ����1molCl����ȫ�ŵ磬ת��1mol���ӣ�e�缫�����ɵ�����Ϊ����������4OH����4e��=2H2O+O2�����������������ʵ���Ϊ0.25mol�����Ϊ0.25mol��22.4L/mol=5.6L��b�缫����Cu2++2e��=Cu������0.5molCu������Ϊ0.5mol��64g/mol=32g����缫b��c��������Ϊ32g�����Դ��ǣ�5.6��32����4��t2sʱ������ֱ����Դ���������˶Ե����������ҺΪ���ᣬaΪ��������������������Ȼ������ͭ���缫����ʽΪ��2H++2e��=H2����Cu2++2e��=Cu�����Դ��ǣ�2H++2e��=H2����Cu2++2e��=Cu��