题目内容
下列叙述中,甲金属一定比乙金属活泼性强的是:
- A.甲原子电子层数比乙原子的电子层数多
- B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
- C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
- D.常温时,甲能从水中置换出氢,而乙不能
D
解析:
试题分析:如金属不位于同一主族,例如Na和Cu,不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;金属的活泼性越强,越易与水反应,所以常温时,甲能从水中置换出氢,而乙不能可以说明甲金属一定比乙金属活泼性强,故D为本题的答案。
考点:金属活动性的比较
点评:本题考查了金属活动性的比较,该考点是考点的常考考点,本题侧重对学生基础知识的考查,本题难度不大。
解析:
试题分析:如金属不位于同一主族,例如Na和Cu,不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;金属的活泼性越强,越易与水反应,所以常温时,甲能从水中置换出氢,而乙不能可以说明甲金属一定比乙金属活泼性强,故D为本题的答案。
考点:金属活动性的比较
点评:本题考查了金属活动性的比较,该考点是考点的常考考点,本题侧重对学生基础知识的考查,本题难度不大。

练习册系列答案
相关题目





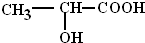 俗称乳酸,乳酸经过聚合制得的聚乳酸树脂,可以广泛用于医疗、包装、纺织等行业. 若用丙烯(其他无机试剂任选)为原料合成乳酸,合成过程中涉及到的反应类型依次是
俗称乳酸,乳酸经过聚合制得的聚乳酸树脂,可以广泛用于医疗、包装、纺织等行业. 若用丙烯(其他无机试剂任选)为原料合成乳酸,合成过程中涉及到的反应类型依次是