题目内容
接触法制硫酸是先把SO2催化氧化成SO3,然后再用水和浓硫酸吸收。某工厂接触室“出口气体”中含有N2、O2和少量的SO2及体积分数为10%的SO3。把“出口气体”送进吸收塔,使SO3转化成发烟硫酸(可以看作是H2SO4与SO3的混合物),其中SO3的质量分数为20%。请计算:(1)若发烟硫酸用H2SO4?xSO3表示,则x的值是多少。
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求448m3(已折算成标准状况)“出口气体”所需水的质量。
(3)若只用98%的浓硫酸来完全吸收SO3生产该发烟硫酸,计算448m3(已折算成标准状况)“出口气体”所需98%的浓硫酸的质量。
依题意,可列式如下:
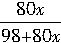 ×100%=20%
×100%=20%解得:x≈0.306。
(2)出口气体中所含SO3的物质的量=
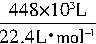 ×10%=2×103mol。
×10%=2×103mol。用水吸收SO3生产发烟硫酸的反应若用常规的化学方程式表示,无疑会给计算带来麻烦,我们可以先将H2SO4?0.306SO3变换成1.306SO3?H2O,然后反应用下式表示:
1.306SO3+H2O=1.306SO3?H2O
1.306mol 18g
2×103mol m(H2O)
解得:m(H2O)=2.76×104g。
(3)本小题的难度最大,解题的关键在于98%的浓硫酸的表示方式。根据组成可知98%的浓硫酸中硫酸和水的比例n(H2SO4)∶n(H2O)=
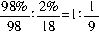 ,故可将其表示为H2SO4?H2O/9或SO3?10H2O/9。则98%的浓硫酸吸收SO3生产发烟硫酸的反应可表示为:
,故可将其表示为H2SO4?H2O/9或SO3?10H2O/9。则98%的浓硫酸吸收SO3生产发烟硫酸的反应可表示为:SO3?10H2O/9+SO3→1.306SO3?H2O
再将该化学方程式配平:
SO3?10H2O/9+
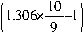 SO3=1.306×10SO3/9?10H2O/9
SO3=1.306×10SO3/9?10H2O/9100g
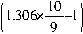 mol
molm(浓硫酸) 2×103mol
解得:m(浓硫酸)=4.43×105g。
【试题分析】

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目