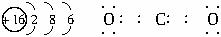题目内容
有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大.B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个.甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐.甲、乙、丙、丁四种物质之间的相互反应关系如下图:
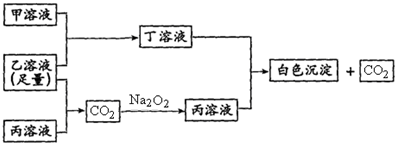
请回答:
(1)写出A的最高价的氧化物的电子式 .
(2)用有关化学用语解释:丙溶液呈碱性的原因 .
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液: ;②丁溶液+丙溶液: .

请回答:
(1)写出A的最高价的氧化物的电子式
(2)用有关化学用语解释:丙溶液呈碱性的原因
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液:
分析:有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,过氧化钠和二氧化碳反应生成碳酸钠和氧气,丙为含A的钠盐,则A是C元素,A元素最外层电子数比B多一个,则B的最外层电子数是3,且B的原子序数大于A,为短周期元素,所以B是Al元素,B元素原子最外层电子数是C元素原子最外层电子数的一半,且C的原子序数大于B,为短周期元素,所以C是S元素,甲为含B的钠盐,则B是NaAlO2,乙为C的最高价氧化物对应的水化物,乙是H2SO4,偏铝酸钠和稀硫酸反应生成硫酸钠、硫酸铝,硫酸铝和碳酸钠溶液反应生成氢氧化铝和二氧化碳、硫酸钠,结合物质的结构、性质分析解答.
解答:解:有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,过氧化钠和二氧化碳反应生成碳酸钠和氧气,丙
为含A的钠盐,则A是C元素,A元素最外层电子数比B多一个,则B的最外层电子数是3,且B的原子序数大于A,为短周期元素,所以B是Al元素,B元素原子最外层电子数是C元素原子最外层电子数的一半,且C的原子序数大于B,为短周期元素,所以C是S元素,甲为含B的钠盐,则B是NaAlO2,乙为C的最高价氧化物对应的水化物,乙是H2SO4,偏铝酸钠和稀硫酸反应生成硫酸钠、硫酸铝,硫酸铝和碳酸钠溶液反应生成氢氧化铝和二氧化碳、硫酸钠,
(1)A是C元素,其最高价氧化物是二氧化碳,二氧化碳分子中碳原子和每个氧原子形成两个共用电子对,所以其电子式为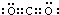 或
或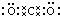 ,故答案为:
,故答案为: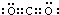 或
或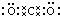 ;
;
(2)碳酸钠是强碱弱酸盐,碳酸根离子易水解而使溶液呈碱性,水解方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(3)①甲溶液是偏铝酸钠溶液,乙溶液是稀硫酸,二者反应生成硫酸铝、硫酸钠和水,离子方程式为:4H++AlO2-=Al3++2H2O,故答案为:4H++AlO2-=Al3++2H2O;
②硫酸铝和碳酸钠溶液反应生成氢氧化铝、二氧化碳和硫酸钠,离子反应方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
为含A的钠盐,则A是C元素,A元素最外层电子数比B多一个,则B的最外层电子数是3,且B的原子序数大于A,为短周期元素,所以B是Al元素,B元素原子最外层电子数是C元素原子最外层电子数的一半,且C的原子序数大于B,为短周期元素,所以C是S元素,甲为含B的钠盐,则B是NaAlO2,乙为C的最高价氧化物对应的水化物,乙是H2SO4,偏铝酸钠和稀硫酸反应生成硫酸钠、硫酸铝,硫酸铝和碳酸钠溶液反应生成氢氧化铝和二氧化碳、硫酸钠,
(1)A是C元素,其最高价氧化物是二氧化碳,二氧化碳分子中碳原子和每个氧原子形成两个共用电子对,所以其电子式为
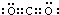 或
或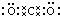 ,故答案为:
,故答案为: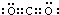 或
或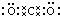 ;
;(2)碳酸钠是强碱弱酸盐,碳酸根离子易水解而使溶液呈碱性,水解方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(3)①甲溶液是偏铝酸钠溶液,乙溶液是稀硫酸,二者反应生成硫酸铝、硫酸钠和水,离子方程式为:4H++AlO2-=Al3++2H2O,故答案为:4H++AlO2-=Al3++2H2O;
②硫酸铝和碳酸钠溶液反应生成氢氧化铝、二氧化碳和硫酸钠,离子反应方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
点评:本题考查了物质的推断,正确推断元素是解本题关键,再结合物质间的反应来分析解答,难点是硫酸铝和碳酸钠溶液的反应,二者发生双水解反应而生成沉淀和气体,为易错点.

练习册系列答案
相关题目