��Ŀ����
����Ŀ����֪���ֶ�����Ԫ�������ڱ��е����λ�������ʾ��
a | |||||
b | |||||
c | d | e |
��1����������Ԫ�ؽ�������ǿ��Ԫ��Ϊ����Ԫ�ط��ţ���c��e��Ԫ���γɵ����ӻ�����c2e�ĵ���ʽΪ ��
��2��c��d��e����Ԫ�صļ������У��뾶��С��������Ԫ�ط��ű�ʾ����
��3��b��e��Ԫ�طֱ���a�γɵ������̬��������ȶ��ԵĹ�ϵΪ���û�ѧʽ��ʾ����
��4����֪A��B��C��D��E��F���ֻ������������Ԫ���еļ�����ɣ�����֮��Ĺ�ϵ��ͼ��ʾ��AΪ����ɫ���壬B�dz���Һ�壬D�����������F�������������Ҫ���壮 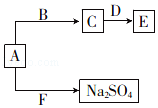
��д������E�Ļ�ѧʽ�� ��
��д��A��F��Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��Na��![]()
��2��Al3+
��3��H2O��H2S����H2S��H2O��
��4��NaAlO2��Na2O2+SO2=Na2SO4
���������⣺��1���������ֶ�����Ԫ����Ԫ�����ڱ��е����λ�ÿ�֪��aΪHԪ�أ�bΪOԪ�أ�cΪNaԪ�أ�dΪAlԪ�ء�eΪSԪ�أ�����Ԫ�ؽ���ΪNaԪ�ء�AlԪ�أ�Na��Al����ͬһ���ڣ�ԭ��������������ͬ����������ң�Ԫ�صĽ����Լ������ʽ�����Na��Al������Ϊ���ӻ����������ֱ�������ӷ��ű�ʾ����������Ҫ���������ɼ��������ӣ����Ƶĵ���ʽΪ ![]() �� ���Դ��ǣ�Na��
�� ���Դ��ǣ�Na�� ![]() ����2��Na+��Al3+������ͬ���Ӳ�ṹ�����Ӳ�����ͬ�����ź˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ�����Ӱ뾶��С�������Ӱ뾶��Na+��Al3+ �� ���Ӳ�Խ�����Ӱ뾶Խ��S2����Na+��Al3+��һ����ӣ��������߰뾶��СΪS2����Na+��Al3+ ��
����2��Na+��Al3+������ͬ���Ӳ�ṹ�����Ӳ�����ͬ�����ź˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ�����Ӱ뾶��С�������Ӱ뾶��Na+��Al3+ �� ���Ӳ�Խ�����Ӱ뾶Խ��S2����Na+��Al3+��һ����ӣ��������߰뾶��СΪS2����Na+��Al3+ ��
���Դ��ǣ�Al3+����3��O��S����ͬһ���壬ͬһ����������·ǽ����Լ�����O�ķǽ����Ա�Sǿ�������ȶ��ԣ�H2O��H2S����H2S��H2O����
���Դ��ǣ�H2O��H2S����H2S��H2O������4����F�������������Ҫ���壬��FΪSO2 �� A��F��Ӧ���������ƣ�AΪ����ɫ���壬��֪AΪNa2O2 �� B�dz���Һ�壬D��������������ת����֪��BΪˮ��CΪNaOH��DΪAl2O3 �� EΪNaAlO2 ��
���Դ��ǣ�NaAlO2��
��AΪNa2O2 �� FΪSO2 �� A��F��Ӧ���������ƣ���Ӧ�Ļ�ѧ����ʽΪNa2O2+SO2=Na2SO4 ��
���Դ��ǣ�Na2O2+SO2=Na2SO4 ��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�����Ŀ��������Ԫ��X��Y��Z��W�����ڱ��е����λ����ͼ��ʾ������WԪ�ص�ԭ�ӽṹʾ��ͼΪ ![]() ����ش��������⣺
����ش��������⣺
W | X | Y |
Z |
��1��ZԪ��λ��Ԫ�����ڱ��е������壮
��2��XԪ�ص������̬�⻯������������������Ӧ��ˮ���ﷴӦ���õ��Ļ���������������ӻ�������ۻ��������
��3��X��Y��Z����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ����
��4��д��W������X������������Ӧˮ�����Ũ��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
