题目内容
下列各图所示装置的气密性检查中,一定漏气的是 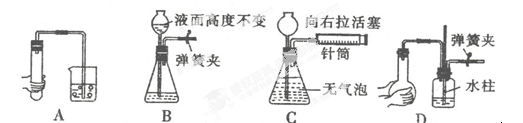
C
解析试题分析:A中属于空气受热膨胀,会冒出气泡,据此可以判断是否漏气,A中不漏气;B中如果不漏气,则液面的高度差是不变的,B中不漏气;C装置中如果不漏气,则向右拉活塞时,锥形瓶内会冒气泡,所以C中是漏气的;D中也依据热胀冷缩的原理来进行检验的,说明不漏气,答案选C。
考点:考查实验基本操作中装置气密性的检查判断
点评:该题是基础性实验的考查,难度不大。气密性检验的原理是:内外产生压强差,会引起不同的现象,然后由现象得出正确的结论.本考点与物理的压强相联系,有利于培养学生的逻辑推理能力,提高学生的综合素质和素养。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



 N2(g)+2CO2(g)的△H=
。
N2(g)+2CO2(g)的△H=
。



