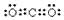题目内容
7.(1)某金属氯化物MCl228.5g,含有0.6molCl-,则该氯化物的摩尔质量为95g/mol,金属M的名称为镁.(2)11.1gCaCl2所含氯离子数与标准状况下约1.5L O3所含氧原子数相等.(计算结果保留一位小数点)
(3)若ag SO2含b个原子,则阿伏加德罗常数为$\frac{64b}{3a}$mol-1(用含a、b的公式表示)
分析 (1)由Cl-的物质的量及MCl2来确定MCl2的物质的量,利用M=$\frac{m}{n}$来计算摩尔质量,最后利用摩尔质量与相对分子质量在数值上相等来解答;
(2)根据n=$\frac{m}{M}$计算出氯化钙的物质的量,所含氯离子数为氯化钙的物质的量2倍,微粒的数目之比等于微粒的物质的量之比,根据V=nVm计算;
(3)根据n=$\frac{m}{M}$计算SO2物质的量,所含原子物质的量为SO2的3倍,结合N=nNA计算.
解答 解:(1)由MCl2含有0.600molCl-,
则MCl2的物质的量为0.300mol,
则该氯化物的摩尔质量为M=$\frac{m}{n}$=$\frac{28.5g}{0.300mol}$=95g/mol,
又摩尔质量与相对分子质量在数值上相等,
则该氯化物的相对分子质量为95,设金属M的相对原子质量为x,
则x+35.5×2=94,解得x=24,为镁元素,
故答案为:95g/mol;镁;
(2)11.1g CaCl2的物质的量n=$\frac{11.1g}{111g/mol}$=0.1mol,氯离子的物质的量是0.2mol,与标准状况下 O3所含氧原子数相等的体积0.2=$\frac{V}{22.4}$×3,解得V≈1.5L,
故答案为:1.5;
(3)SO2物质的量为$\frac{ag}{64g/mol}$=$\frac{a}{64}$mol,所含原子物质的量为SO2的3倍,则N=$\frac{a}{64}$mol×3×NA,故NA=$\frac{64b}{3a}$mol-1.,
故答案为:$\frac{64b}{3a}$mol-1.
点评 本题考查有关物质的量的计算,明确质量、摩尔质量、物质的量的关系及摩尔质量与相对分子质量的关系和物质的结构是解题关键,难度不大.

| A. | “熬胆矾铁釜,久之亦化为铜”,该过程主要发生了置换反应 | |
| B. | 古剑“沈卢”,“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| C. | 《本草经集注》对区分硝石(硝酸钾)和硝朴(硫酸钠)有记载“以火烧之,紫青烟起,乃真硝石也”利用的是焰色反应 | |
| D. | 《周易参同契》中对汞的描述“…得火则飞,不见埃尘,将欲制之,黄芽为根”这里的“黄芽”是指过氧化钠 |
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V${\;}_{C{O}_{2}}$(标况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的物质的量分数为45.7% | |
| C. | 9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g | |
| D. | 15.7g混合物恰好与盐酸完全反应 |
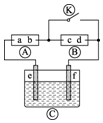 如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通
如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A. | f电极为锌板 | B. | c极发生的反应为2H++2e-═H2↑ | ||
| C. | a为直流电源的正极 | D. | e极发生氧化反应 |
| A. | 用惰性电极电解饱和食盐水,若电路中通过NA个电子,则阴极一定产生11.2LCl2 (标况) | |
| B. | lmolCH3COOC2H5在稀硫酸溶液中受热水解可得到乙醇分子数为NA | |
| C. | 含NA个Na+的Na2O2溶解于水配成2L溶液,所得溶液中Na+的物质的量浓度为0.5mol/L | |
| D. | 足量的MnO2固体与1L12mol/L的浓盐酸加热时反应,生成Cl2的分子数为3NA |

| A. | 能发生银镜发应 | |
| B. | 分子式为C10H10NO2 | |
| C. | 1mol 该物质最多可与5mol H2反应 | |
| D. | 吲哚-3-乙酸可发生加成反应和取代反应 |

 ;⑧的原子结构示意图为
;⑧的原子结构示意图为 .
.