题目内容
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填字母)。
a. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b. 大力开采煤、石油和天然气以满足人们日益增长的能源需求
c. 开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d. 减少资源消耗,增加资源的重复使用、资源的循环再生?
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
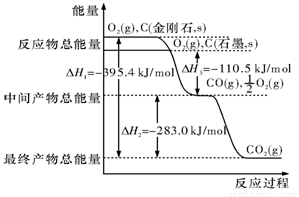
(a)在通常状况下,金刚石和石墨相比较, (填”金刚石”或”石墨”)更稳定,石墨的燃烧热为 。
(b)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ ▪ mol-1、497 kJ ▪ mol-1。
N2 (g)+ O2 (g)=== 2 NO (g) H=+180.0 kJ ▪ mol-1。
NO分子中化学键的键能为 kJ ▪ mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式: 。
(1)acd (2)石墨 -393.5 kJ ▪ mol-1 252.0 kJ (3)631.5
(4)2NO(g)+2CO(g)=== N2(g)+ 2CO2 (g) △H=-746.0 kJ ▪ mol-1
【解析】(1)煤、石油、天然气都是化石燃料,是不可再生的,所以大力开采煤、石油和天然气以满足人们日益增长的能源需求是错误的,不可取的,其余都是正确的,答案选acd。
(2)(a)根据图像可知,金刚石的总能量大于石墨的,所以石墨比金刚石稳定。燃烧热是在一定条件下,1mol可燃物完燃烧生成稳定的氧化物时所放出的热量,所以根据图像可以看出石墨的燃烧热是110.5kJ/mol+283.0kJ/mol=393.5kJ/mol。
(b)12g石墨完全生成CO2,质量是44g,完全生成CO是28g,所以36g气体是混合气。设CO2和CO的物质的量分别是x和y,则x+y=1mol、44x+28y=36g,解得x=y=0.5mol,所以实际放出的热量是0.5mol×(110.5kJ/mol+393.5kJ/mol)=252.0kJ。
(3)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以946kJ/mol+497kJ/mol-2x=+180.0kJ/mol,解得x=631.5kJ/mol,即NO分子中化学键的键能为631.5kJ/mol。
(4)根据图像可知①2CO(g)+O2 (g)=== 2CO2 (g) △H=-566kJ/mol,又因为②N2 (g)+ O2 (g)=== 2 NO (g) H=+180.0 kJ ▪ mol-1,所以根据盖斯定律可知,①-②即得到2NO(g)+2CO(g)=== N2(g)+ 2CO2 (g),所以反应热△H=-566kJ/mol-180kJ/mol=-746.0 kJ ▪ mol-1。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案请回答下列问题:
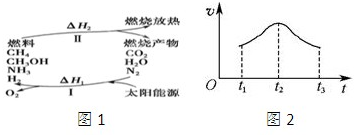
(1)过程Ⅰ的能量转化形式为
(2)上述转化过程中,△H1和△H2的关系是
(3)断裂1mol化学键所需的能量见下表:
| 共价键 | H-N | H-O | N≡N | O═O |
| 断裂1mol化学键所需能量/(kJ?mol-1) | 393 | 460 | 941 | 499 |
(Ⅱ)在一试管中加入0.01mol/L的KMnO4酸性溶液和0.1mol/L H2C2O4溶液,在恒温下发生如下反应:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2+8H2O;5分钟后测得Mn2+的浓度为0.004mol/L;
(4)试计算0-5分钟内,v(H2C2O4)=
(5)如果反应从开始进行一段时间后,速率-时间图象如图2:试解释t1-t2,t2-t3速率变化的原因.
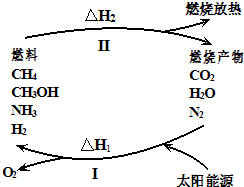 保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:过程I可用如下反应表示:
①2CO2
| ||
②2H2O
| ||
③2N2+6H2O
| ||
④2CO2+4H2O
| ||
⑤2CO+H2O
| 光能 |
请回答下列问题:
(1)过程I的能量转化形式为:
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
| 共价键 | H-N | H-O | N≡N | O=O |
| 断裂1mol化学键所需 能量/kJ?mol-1 |
393 | 460 | 941 | 499 |
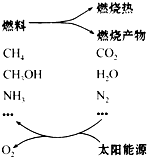 环境保护已成为当前和未来的一项全球性重大课题之一.为消除目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能 促进燃料循环使用的构想(如图).
环境保护已成为当前和未来的一项全球性重大课题之一.为消除目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能 促进燃料循环使用的构想(如图).