题目内容
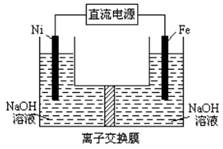
甲醇、氧气和强碱溶液做电解质的手机电池中的反应为:
2CH3OH+3O2+4OH-  2CO32-+6H2O,有关说法正确的是
2CO32-+6H2O,有关说法正确的是
| A.放电时,CH3OH参与反应的电极为正极 |
| B.放电时,负极电极反应:CH3OH+8OH--6e- =CO32-+6H2O |
| C.标况下,通入11.2LO2完全反应有1mol电子转移 |
| D.充电时电解质溶液的pH逐渐减小 |
B
解析试题分析:A、放电时,CH3OH发生氧化反应,所以CH3OH参与反应的电极为负极,错误;B、放电时,负极为甲醇的氧化反应,结合电解质溶液,反应式为CH3OH+8OH--6e- =CO32-+6H2O,正确;C、标况下,11.2LO2的物质的量为0.5mol,所以11.2LO2完全反应有0.5mol×4=2mol电子转移,错误;D、充电时,反应从右向左进行,氢氧根离子浓度增大,溶液pH逐渐升高,错误,答案选B。
考点:考查燃料电池的反应原理

练习册系列答案
相关题目
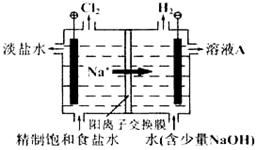
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | Pb(NO3)2 |
| C | FeSO4 | Al2 (SO4)3 |
| D | CuSO4 | AgNO3 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(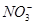 )=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+)为2 mol·L-1 |
| B.上述电解过程中共转移6 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol·L-1 |
铜—锌—稀硫酸组成的原电池,放电一段时间后,溶液的pH将( )
| A.不变 | B.升高 |
| C.降低 | D.无法确定 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )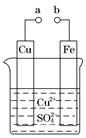
| A.a 和 b 不连接时,铁片上会有金属铜析出 |
| B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu |
| C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
| D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
下列与金属腐蚀有关的说法,正确的是
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
[双选题]为了避免青铜器生成铜绿,以下方法正确的是( )
| A.将青铜器放在银质托盘上 |
| B.将青铜器保存在干燥的环境中 |
| C.将青铜器保存在潮湿的空气中 |
| D.在青铜器的表面覆盖一层防渗透的高分子膜 |