题目内容
若NA表示阿伏伽德罗常数的值,下列说法正确的是
- A.0.1mol/L的 NH4Cl溶液中所含Cl-数为0.1NA
- B.4.6 g NO2与足量水反应,转移电子数为0.2NA
- C.常温常压下,1.8g NH4+含有的电子数为1NA
- D.常温下,0.1mol Fe与稀硝酸完全反应时,失去的电子数一定为0.3NA
C
分析:A、题中没有告诉氯化铵溶液的体积,无法计算氯化铵的物质的量;
B、二氧化氮与水的反应,二氧化氮既是氧化剂,又是还原剂;
C、铵离子含有10个电子,1.8g的物质的量是0.1mol;
D、需要分析铁是否过量,生成的是亚铁离子还是三价铁离子.
解答:A、由于不知氯化铵溶液的体积,无法计算0.1mol/L的 NH4Cl溶液中所含Cl-数,故A错误;
B、4.6 g NO2的物质的量是0.1mol,与水反应,二氧化氮既是氧化剂,又是还原剂,被还原的有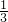 ×0.1mol,转移电子物质的量是
×0.1mol,转移电子物质的量是  mol,故B错误;
mol,故B错误;
C、1.8g NH4+的物质的量是0.1mol,铵离子有10个电子,1.8g NH4+含有的电子数为1NA,故C正确;
D、Fe与稀硝酸反应生成的产物可能是亚铁离子,也可能是铁离子,故0.1mol Fe与稀硝酸完全反应时,失去的电子数在0.2mol~0.3mol之间,故D错误;
故选C.
点评:本题考查阿伏伽德罗常数,计算溶液中离子的物质的量,必须知道溶液体积,本题难度一般.
分析:A、题中没有告诉氯化铵溶液的体积,无法计算氯化铵的物质的量;
B、二氧化氮与水的反应,二氧化氮既是氧化剂,又是还原剂;
C、铵离子含有10个电子,1.8g的物质的量是0.1mol;
D、需要分析铁是否过量,生成的是亚铁离子还是三价铁离子.
解答:A、由于不知氯化铵溶液的体积,无法计算0.1mol/L的 NH4Cl溶液中所含Cl-数,故A错误;
B、4.6 g NO2的物质的量是0.1mol,与水反应,二氧化氮既是氧化剂,又是还原剂,被还原的有
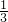 ×0.1mol,转移电子物质的量是
×0.1mol,转移电子物质的量是  mol,故B错误;
mol,故B错误;C、1.8g NH4+的物质的量是0.1mol,铵离子有10个电子,1.8g NH4+含有的电子数为1NA,故C正确;
D、Fe与稀硝酸反应生成的产物可能是亚铁离子,也可能是铁离子,故0.1mol Fe与稀硝酸完全反应时,失去的电子数在0.2mol~0.3mol之间,故D错误;
故选C.
点评:本题考查阿伏伽德罗常数,计算溶液中离子的物质的量,必须知道溶液体积,本题难度一般.

练习册系列答案
相关题目