��Ŀ����
����Ŀ����1��д������������ˮ��Һ�еĵ��뷽��ʽ��
��Ba��OH��2�� ��
��NaHSO4�� ��
��д���٢�ˮ��Һ��Ϻ�ǡ�ó�����ȫ�����ӷ���ʽ______________________
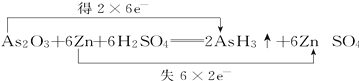
��2���鼰�仯�����ж�������˪��As2O3���о綾���������ͷ�ҽѧ������˪�ж��ķ�Ӧԭ����As2O3+6Zn+12HCl=6ZnCl2+2AsH3��+3H2O������Ӧ�л�ԭ���� ������ԭ��Ԫ���� �����û�ѧʽ�ش������μӷ�ӦZn������Ϊ19.5g�������ɵ������ڱ�״���µ����Ϊ_________L��
����˫���ŷ����������Ӧ�е���ת�Ƶķ������Ŀ��
��3��ʵ��������Ҫ������NaCl��Һ�����ֱ�ֻ�л���Na2SO4��NH4HCO3��NaCl��ijѧ���������ͼ��ʾ������ȡ������NaCl��Һ������֪��NH4HCO3![]() NH3��+CO2��+H2O��
NH3��+CO2��+H2O��
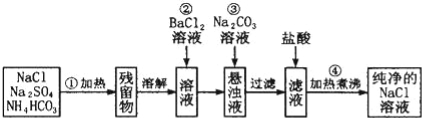
��150��ʱ��һ������NH4HCO3��ȫ�ֽ�����������ƽ����Է�������Ϊ ��������С�����һλ����
�����������õ�������Һ�뽺��ı��������� ��
�����в��������ж�SO42���Ƿ��ѳ��������� ��
����������BaCl2��Һ�����ɳ��������ؽ��й��˾Ϳɽ��в�������̼������Һ���������� ��
���𰸡�
��1����Ba��OH��2=Ba2++2OH-��
��NaHSO4=Na++H++SO42-��
��Ba2++OH-+H++SO42-=BaSO4��+H2O��
��2����Zn�� As��2.24��
��
��3����26.3������ɢ����ֱ����С��ͬ����ȡ�����ϲ������Һ���ٵμ�BaCl2��Һ��������������˵��SO42-�ѳ�������֮�������������ķ������������˵Ĵ���Խ�٣�Խ�ܼ������ʵ���ʧ��
��������
�����������1����Ba��OH��2�ĵ��뷽��ʽΪBa��OH��2=Ba2++2OH-���ʴ�Ϊ��Ba��OH��2=Ba2++2OH-��
��NaHSO4�ĵ��뷽��ʽΪNaHSO4=Na++H++SO42-���ʴ�Ϊ��NaHSO4=Na++H++SO42-��
��д���٢�ˮ��Һ��Ϻ�ǡ�ó�����ȫ�����ӷ���ʽΪBa2++OH-+H++SO42-=BaSO4��+H2O���ʴ�Ϊ��Ba2++OH-+H++SO42-=BaSO4��+H2O��
��2��As2O3+6Zn+12HCl=6ZnCl2+2AsH3��+3H2O�У�ZnԪ�صĻ��ϼ����ߣ�ZnΪ��ԭ����ʧȥ���ӱ�������Zn������Ϊ19.5g�����ʵ���Ϊ![]() =0.3mol�������ɵ������ڱ�״���µ����Ϊ
=0.3mol�������ɵ������ڱ�״���µ����Ϊ![]() �� 2 �� 22.4 L/mol=2.24L����˫���ŷ���ʾ����ת��Ϊ
�� 2 �� 22.4 L/mol=2.24L����˫���ŷ���ʾ����ת��Ϊ ��
��
��3������̼����淋����ʵ���Ϊ1mol����
NH4HCO3![]() NH3��+CO2��+H2O
NH3��+CO2��+H2O
1mol 1mol 1mol 1mol
������ˮ�Ͷ�����̼�������ֱ�Ϊ17g��44g��18g����150��ʱ��ˮʱ���壬�������������ƽ��Ħ������M=![]() =26.3g/mol����Է�������26.3���ʴ�Ϊ��26.3��
=26.3g/mol����Է�������26.3���ʴ�Ϊ��26.3��
������Һ�뽺��ı��������Ƿ�ɢ����ֱ����С��ͬ���ʴ�Ϊ����ɢ����ֱ����С��ͬ��
����������Ȼ�����Һ��ȥ��������ӣ���������������ѳ������ɾ�ֹƬ�����ϲ���Һ�����μ�һ���Ȼ�����Һ�������ֻ��Ǿ�˵������������Ѿ��������ʴ�Ϊ��ȡ�����ϲ������Һ���ٵμ�BaCl2��Һ��������������˵��SO42-�ѳ�������֮�������������ķ�������
����������BaCl2��Һ�����ɳ��������ؽ��й��˾Ϳɽ��в�������̼������Һ�����˵Ĵ���Խ�٣����Լ������ʵ���ʧ���ʴ�Ϊ�����˵Ĵ���Խ�٣�Խ�ܼ������ʵ���ʧ��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�����Ŀ��������ؼ�ͥʵ���ܴﵽԤ��Ŀ�ĵ���
���ʵ�� | Ԥ��Ŀ�� | |
A | ������ʳ�ü���һ���Լ������ʳ�� | ̽��ʳ�ü���̼���ƻ���̼������ |
B | ��ʳ���εμ���������Һ | ̽��ʳ�����Ƿ�Ϊ�ӵ��� |
C | �ü�����������Һ | ̽������Һ�ǽ��廹����Һ |
D | ������������ˮ�μ�AgNO3��Һ | ��֤�������к�����Ԫ�� |
A. A B. B C. C D. D