题目内容
【题目】根据题意解答
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2 , 若将此反应设计成原电池,则负极所用电极材料为 , 当线路中转移0.1mol电子时,则被腐蚀铜的质量为g,正极的电极方程式为 .
(2)已知甲醇燃料电池的工作原理如图所示. 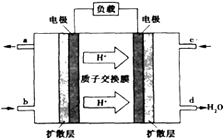
该电池工作时,b口通入的物质为 , 该电池正极的电极反应式为: , 工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有mol电子发生转移.
(3)若将(3)中电池的电解质溶液换为KOH溶液,则负极的电极方程式为 .
【答案】
(1)Cu;3.2;2Fe3++2e﹣=2Fe2+
(2)CH3OH;3O2+12e﹣+12H+=6H2O;1.2
(3)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
【解析】解:(1)该电池反应中,铜失电子发生氧化反应作负极,负极反应式为Cu﹣2e﹣=Cu2+ , 正极是三价铁离子得电子发生还原反应,电极反应为:2Fe3++2e﹣=2Fe2+ , 当线路中转移0.1mol电子时,反应的Cu为0.05mol,其质量为0.05mol×64g/mol=3.2g; 所以答案是:Cu;3.2;2Fe3++2e﹣=2Fe2+;(2)根据装置氢离子向右移动,说明右边的电极是正极,所以e口是通入的氧气,故b口通入的是CH3OH,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e﹣+12H+=6H2O;甲醇的物质的量为 ![]() =0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当0.2mol甲醇完全反应生成CO2时,转移电子是1.2mol,
=0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当0.2mol甲醇完全反应生成CO2时,转移电子是1.2mol,
所以答案是:CH3OH;3O2+12e﹣+12H+=6H2O;1.2;(3)若将电池的电解质溶液换为KOH溶液,二氧化碳会与氢氧化钾反应生成碳酸钾和水,电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
所以答案是:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案【题目】现有部分短周期元素的性质、应用或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层电子数是K层电子数的3倍 |
X | 一种同位素可测定文物年代 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X可测定文物年代的同位素符号是 .
(2)元素Z在周期表中的位置为 . Y单质的结构式为 .
(3)元素Y与氢元素形成一种离子YH4+ , 实验室检验溶液中含有这种离子方法是:(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
【题目】除去下列物质中的杂质选用的试剂和方法最合理的是
物质 | 杂质 | 试剂 | 方法 | |
A | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
D | 铜 | 氧化铜 | 稀硝酸 | 萃取 |
A. A B. B C. C D. D