题目内容
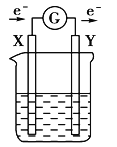
【题目】某课外活动小组同学用图一装置进行实验,试回答下列问题。

(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的_______腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式____________________。
(2)用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
① 该电解槽的阳极反应式为:_______________
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)___________导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为________________。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有_________kJ的能量转化为电能。
【答案】 吸氧 ![]()
![]() D
D ![]() 571.6
571.6
【解析】(1)① 若开始时开关K与a连接,则构成原电池,由于溶液显中性,所以钢铁发生的是吸氧腐蚀。②若开始时开关K与b连接,则构成电解池,石墨和电源的正极相连,作阳极,溶液中的氯离子放电,铁和电源的负极相连,作阴极,溶液中的氢离子放电,所以方程式为2Cl﹣+ 2H2O![]() 2OH﹣+ H2↑ + Cl2↑;(2)①电解槽中阳极是氢氧根失去电子,电极反应式为4OH――4e-=2H2O+O2↑;②阴极氢离子得电子生成氢气,阴极反应式为2H+ + 2 e- = H2↑,因此氢氧化钠在阴极生成,所以从D处导出。③在氢氧燃料电池中,氧气在正极通入,氢气在负极通入,由于溶液是氢氧化钠溶液,因此负极电极反应式为H2 -2e﹣+ 2OH﹣=2H2O ;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,1mol氢气燃烧生成1mol水,36g水的物质的量为36g÷18g/mol=2mol,所以生成36g水放出的热量是285.8 kJ/mol×2mol=571.6kJ,即有571.6的能量转化为电能。
2OH﹣+ H2↑ + Cl2↑;(2)①电解槽中阳极是氢氧根失去电子,电极反应式为4OH――4e-=2H2O+O2↑;②阴极氢离子得电子生成氢气,阴极反应式为2H+ + 2 e- = H2↑,因此氢氧化钠在阴极生成,所以从D处导出。③在氢氧燃料电池中,氧气在正极通入,氢气在负极通入,由于溶液是氢氧化钠溶液,因此负极电极反应式为H2 -2e﹣+ 2OH﹣=2H2O ;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,1mol氢气燃烧生成1mol水,36g水的物质的量为36g÷18g/mol=2mol,所以生成36g水放出的热量是285.8 kJ/mol×2mol=571.6kJ,即有571.6的能量转化为电能。

【题目】下列分离或提纯有机物的方法正确的是( )
选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
A | 乙烷 | 乙烯 | 酸性 KMnO4溶液, 洗气 |
B | 溴苯 | 溴 | NaOH 溶液,分液 |
C | 乙酸 | 乙醇 | 金属钠,蒸馏 |
D | 乙醇 | 水 | 生石灰,过滤 |
A. A B. B C. C D. D