题目内容
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体 积变化曲线如图所示。下列有关说法不正确的是( )
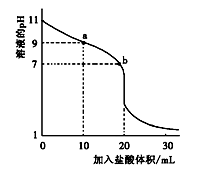

| A.b点:c(M+)+c(MOH)=c(Clˉ) |
| B.a到b点的水溶液导电性依次增强 |
| C.该一元碱溶液浓度为0.100 0 mol·L-1 |
| D.室温下,MOH的电离常数Kb=1×10-5 |
A
试题分析:A.b点时溶液为中性,根据电荷守恒可得c(M+)+c(H+)=c(Clˉ)+c(OH-).由于溶液为中性。所以c(H+)=c(OH-)。两式相减可得c(M+)=c(Clˉ)。错误。B.a到b点的水溶液中的电解质由弱电解质变为强电解质,自由移动的离子的浓度逐渐增大,所以导电性依次增强。正确。C.在pH=7时消耗的HCl的体积为20ml,因为在此时酸碱的物质的量相等。所以该一元碱溶液浓度为0.100 0 mol/L.正确。D.室温下,MOH的电离常数Kb=1×10-5
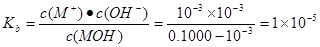 。正确。
。正确。
练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
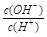 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
 NH3 ·H2O
NH3 ·H2O
 CH3COO-+H+
CH3COO-+H+ H++HS-
H++HS-