题目内容
(14分)
科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。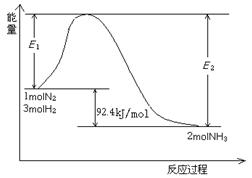
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |

⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
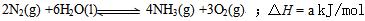
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知
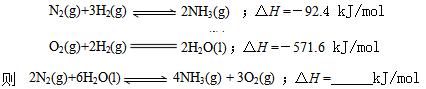
⑷ NH4Cl溶液呈酸性,这是由于NH
 水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
(14分,每空2分)
⑴ ①减小 ② 33.3% ③ A D
⑵ N2 + 6H+ + 6e- = 2NH3
⑶ ①大于 ②+1530.0
⑷ NH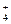 + D2O
+ D2O  NH3·HDO + D+
NH3·HDO + D+
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。