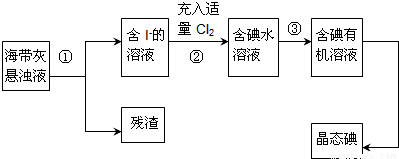
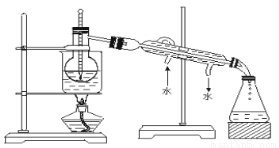
��Ŀ����
����˵������ȷ����
A�������ʵ���Ũ�ȵ� NH4HSO4��Һ��NaOH��Һ�������ϣ���Һ�и�����Ũ�ȴ�С��ϵΪ��c(Na+)=c(SO42��)��c(NH4+)��c(H+)��c(OH��)
B��25�� ʱ���� a mo1•L��l ��ˮ�� 0.01 moI•L��1 ����������ϣ���Ӧ��ȫʱ��Һ��c(NH4+)=c(C1��)���ú�a�Ĵ��� ʽ��ʾNH3•H2O�ĵ��볣��Kb=
ʽ��ʾNH3•H2O�ĵ��볣��Kb= 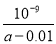
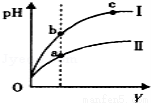
C��ij�¶��£���ͬ�������ͬpH������ʹ�����Һ�ֱ��ˮϡ�ͣ�pH����Һ���V�仯�� ������ͼ��ʾ����Ϊ����ϡ��ʱpH�ı仯���ߣ���a��b����ˮ�ĵ���̶ȣ�a��b
D����֪298Kʱ������(HCN)��Ka=4.9��10��10��̼���Ka1=4.4��10��7��Ka2=4.7��10��11���ݴ˿��Ʋ⽫��������뵽̼������Һ���ܹ۲쵽�����ݲ���
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ


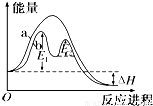
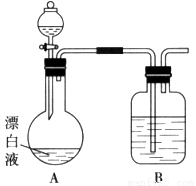
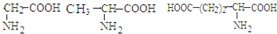 ���ְ�������ˮ���������� 6 �ֶ���
���ְ�������ˮ���������� 6 �ֶ���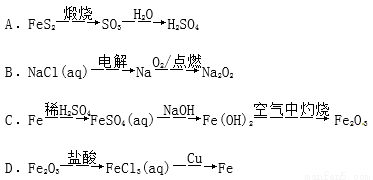
 ����
����