题目内容
(9分) 在500mL 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液 多少毫升?
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液 多少毫升?
(1)设生成的气体是X(标准状况),则
3Cu + 8HNO3=3Cu(NO3)2+4H2O+2NO↑
3×64g 8mol 2×22.4L
1.92g n(HNO3) X
所以有x=
消耗硝酸n(HNO3)=
(2)原硝酸的物质的量是0.5L×0.2mol/L=0.1mol
所以剩余硝酸是0.1mol-0.08mol=0.02mol
则氢离子的浓度是0.02mol÷0.5L=0.04mol/L
(3)根据铜原子守恒可知,生成硝酸铜是1.92g÷64g/mol=0.03mol
因此反应后的溶液中含有0.02mol硝酸和0.03mol硝酸铜
所以要使溶液中的Cu2+全部转化为Cu(OH)2沉淀
需要氢氧化钠的物质的量是0.02mol+0.03mol×2=0.08mol
体积是0.08mol÷0.2mol/L=0.4L=400ml
3Cu + 8HNO3=3Cu(NO3)2+4H2O+2NO↑
3×64g 8mol 2×22.4L
1.92g n(HNO3) X
所以有x=

消耗硝酸n(HNO3)=

(2)原硝酸的物质的量是0.5L×0.2mol/L=0.1mol
所以剩余硝酸是0.1mol-0.08mol=0.02mol
则氢离子的浓度是0.02mol÷0.5L=0.04mol/L
(3)根据铜原子守恒可知,生成硝酸铜是1.92g÷64g/mol=0.03mol
因此反应后的溶液中含有0.02mol硝酸和0.03mol硝酸铜
所以要使溶液中的Cu2+全部转化为Cu(OH)2沉淀
需要氢氧化钠的物质的量是0.02mol+0.03mol×2=0.08mol
体积是0.08mol÷0.2mol/L=0.4L=400ml
考查根据方程式进行的有关计算。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目


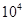 L(标准状况)该尾气需42.5gNH3,则x= 。
L(标准状况)该尾气需42.5gNH3,则x= 。