题目内容
【题目】粗盐中除含有Ca2+、Mg2+、SO42﹣等可溶性杂质外,还含有泥砂等不溶性杂质.
(1)检验溶液中含有SO42﹣的方法是 .
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀.这些操作的目的是 , 滴加Na2CO3溶液时发生反应的化学方程式为 .
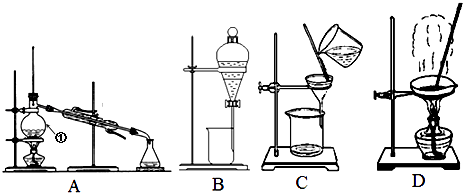
(3)用提纯后的NaCl固体配制100mL 1.0mol/L NaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要(填仪器名称).转移溶液时没有洗涤烧杯会造成所配溶液浓度偏(填“高”或“低”,下同);定容时仰视刻度线会造成所配溶液浓度偏 .
【答案】
(1)取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42﹣
(2)依次除去Mg2+、SO42﹣、Ca2+和过量的Ba2+;BaCl2+Na2CO3=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)100mL容量瓶、胶头滴管;低;低
【解析】解:(1)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;
故答案为:取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42﹣; (2)在粗盐提纯的过程中需要滴加量NaOH溶液、BaCl2溶液和Na2CO3溶液目的是分别除去Mg2+、SO42﹣和Ca2+以及的Ba2+ , 由于加入Na2CO3溶液的目的是除去Ca2+和过量的Ba2+ , 故离子方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl;故答案为:依次除去Mg2+、SO42﹣、Ca2+和过量的Ba2+;BaCl2+Na2CO3=BaCO3↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl; (3)根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、移液、洗涤、定容、摇匀可知所需的仪器有托盘天平、烧杯、玻璃棒、药匙和100mL容量瓶、胶头滴管,故还缺少的仪器有100mL容量瓶、胶头滴管;转移溶液时没有洗涤烧杯会造成溶质的损失,则所配溶液浓度偏低;
定容时仰视刻度线会造成溶液体积偏大,则所配溶液浓度偏低,故答案为:100mL容量瓶、胶头滴管;低;低.
(1)加入氯化钡溶液检验硫酸根离子是否除尽;(2)在粗盐提纯的过程中需要滴加量NaOH溶液、BaCl2溶液和Na2CO3溶液除去镁离子、硫酸根和钙离子以及过量的钡离子;(3)根据配制一定物质的量浓度的溶液的步骤是:计算、称量、溶解、移液、洗涤、定容、摇匀来选择使用的仪器;根据C= ![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.

 阅读快车系列答案
阅读快车系列答案