题目内容
| |||||||||||||||||||
解析:
(1) |
1s22s22p63s23p63d64s2 |
(2) |
三角锥形,sp3,角形(或V形),sp2,极性 |
(3) |
Si,2 |
(4) |
SiC(或jc,或前者) ⑩因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高. |

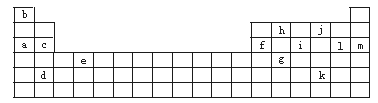
(1)下列__________(填写编号)组元素的单质可能都是电的良导体.
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力
2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
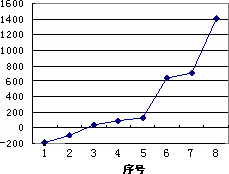
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量.
_________________________________________________________________________
②表中X可能为以上13种元素中的__________(填写字母)元素.用元素符号表示X和j形成化合物的化学式__________.
③Y是周期表中__________族元素.
④以上13种元素中,__________(填写字母)元素原子失去核外第一个电子需要的能量最多.
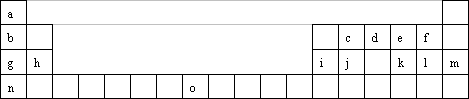
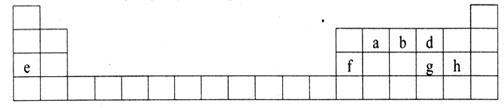
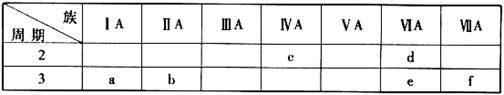 下表是元素周期表的一部分,有关说法正确的是
下表是元素周期表的一部分,有关说法正确的是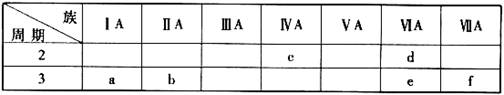 下表是元素周期表的一部分,有关说法正确的是
下表是元素周期表的一部分,有关说法正确的是