题目内容
(12分)
Ⅰ.某温度下,0.1 mol/L的氢硫酸溶液中存在平衡:
①H2S(aq) H+(aq)+HS-(aq);②HS-(aq)
H+(aq)+HS-(aq);②HS-(aq) H+(aq)+S2-(aq);
H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有 。(不完整不给分)
(2)若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | C | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式 。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是 。

Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH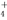 )=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
练习册系列答案
相关题目
 H3COOH
H3COOH

 中两圆相交部分(A、B、C、D)表示物质间的
中两圆相交部分(A、B、C、D)表示物质间的 反应,其中对应反应的离子方程式书写正确的是
反应,其中对应反应的离子方程式书写正确的是
 cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )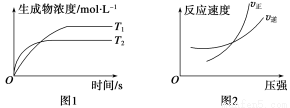
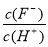 D.
D.
 Ba2++SO42-
Ba2++SO42-