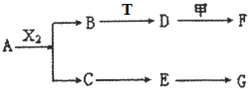题目内容
 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ,R、X、T的原子半径从小到大的顺序为: (用元素符号表示);T与X形成的化合物T2X2含有的化学键类型是: .
(2)A和G等物质的量反应生成的产物的水溶液显 性,其原因用离子方程式表示为 ;
(3)A和X2反应的化学方程式为 ;金属甲与D溶液反应生成F的离子方程式为: .
(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和一氧化碳反应转化为两种空气的成分,当有22.4L的E(标准状况)转化时,转移的电子数为 NA.
【答案】分析:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色判断为NH3,D为碱,G为酸,金属甲在G 的浓溶液中会钝化,说明金属甲可能是铝、铁,酸可以是浓硫酸或浓硝酸;转化关系中金属甲能和碱D反应,判断甲为Al,D为强碱;A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍,原子序数可以为3或8;R和X相邻说明是Be或N、F;Q和T同主族,Q为非金属元素,T为金属元素,只能是第一主族,Q为H,T为Na,R为N,X为O;推断为:A、NH3,B、H2O,T为Na,D为NaOH,F为NaAlO2;C为NO,E为NO2,G为HNO3;依据判断出的物质分析判断.
解答:解:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色判断为NH3,D为碱,G为酸,金属甲在G 的浓溶液中会钝化,说明金属甲可能是铝、铁,酸可以是浓硫酸或浓硝酸;转化关系中金属甲能和碱D反应,判断甲为Al,D为强碱;A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍,原子序数可以为3或8;R和X相邻说明是Be或N、F;Q和T同主族,Q为非金属元素,T为金属元素,只能是第一主族,Q为H,T为Na,R为N,X为O;推断为:A、NH3,B、H2O,T为Na,D为NaOH,F为NaAlO2;C为NO,E为NO2,G为HNO3;(1)X为氧元素,在周期表中的位置是:第二周期,ⅥA族,R(N)、X(O)、T(Na)的原子半径从小到大的顺序为:Na>N>O,T与X形成的化合物是Na2O2含有的化学键类型是:离子键、非极性共价键,
故答案为:第二周期,ⅥA族;Na>N>O;离子键、非极性共价键;
(2)A(NH3)和G(HNO3)等物质的量反应生成的产物为硝酸铵,铵根离子水溶液水解呈酸性,原因为NH4++H2O?NH3?H2O+H+,故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)A(NH3)和X2(O2)反应的化学方程式为:4NH3+5O2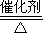 4NO+6H2O;金属甲(Al)与D(NaOH)溶液反应生成F的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:4NH3+5O2
4NO+6H2O;金属甲(Al)与D(NaOH)溶液反应生成F的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:4NH3+5O2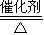 4NO+6H2O;
4NO+6H2O;
(4)安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2NO2+4CO=N2+4CO2,当有22.4L的E(标准状况)物质的量为1mol,每2molNO2反应转化电子8mol,所以1molNO2反应转移的电子数为4×6.02×1023,故答案为:2.408×1024.
点评:本题考查了物质转化关系的分析判断,物质性质的应用,原子结构的特征判断,元素种类的推断方法,主要是氮及其化合物性质的运用和分析判断.
解答:解:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色判断为NH3,D为碱,G为酸,金属甲在G 的浓溶液中会钝化,说明金属甲可能是铝、铁,酸可以是浓硫酸或浓硝酸;转化关系中金属甲能和碱D反应,判断甲为Al,D为强碱;A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍,原子序数可以为3或8;R和X相邻说明是Be或N、F;Q和T同主族,Q为非金属元素,T为金属元素,只能是第一主族,Q为H,T为Na,R为N,X为O;推断为:A、NH3,B、H2O,T为Na,D为NaOH,F为NaAlO2;C为NO,E为NO2,G为HNO3;(1)X为氧元素,在周期表中的位置是:第二周期,ⅥA族,R(N)、X(O)、T(Na)的原子半径从小到大的顺序为:Na>N>O,T与X形成的化合物是Na2O2含有的化学键类型是:离子键、非极性共价键,
故答案为:第二周期,ⅥA族;Na>N>O;离子键、非极性共价键;
(2)A(NH3)和G(HNO3)等物质的量反应生成的产物为硝酸铵,铵根离子水溶液水解呈酸性,原因为NH4++H2O?NH3?H2O+H+,故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)A(NH3)和X2(O2)反应的化学方程式为:4NH3+5O2
 4NO+6H2O;金属甲(Al)与D(NaOH)溶液反应生成F的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:4NH3+5O2
4NO+6H2O;金属甲(Al)与D(NaOH)溶液反应生成F的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;(4)安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2NO2+4CO=N2+4CO2,当有22.4L的E(标准状况)物质的量为1mol,每2molNO2反应转化电子8mol,所以1molNO2反应转移的电子数为4×6.02×1023,故答案为:2.408×1024.
点评:本题考查了物质转化关系的分析判断,物质性质的应用,原子结构的特征判断,元素种类的推断方法,主要是氮及其化合物性质的运用和分析判断.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
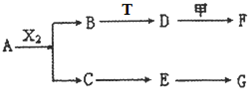 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.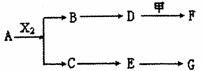
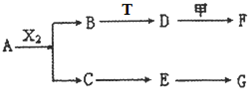 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.