题目内容
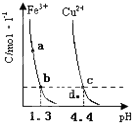 (2011?南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
(2011?南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
分析:A.由a点变到b点,pH增大;
B.Kw只与温度有关,与溶液的酸碱性无关;
C.注意分析处在曲线上的点与曲线外的点有什么区别;
D.根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、c进行计算.
B.Kw只与温度有关,与溶液的酸碱性无关;
C.注意分析处在曲线上的点与曲线外的点有什么区别;
D.根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、c进行计算.
解答:解:A.向溶液中加入氨水,溶液的pH增大,则铁离子浓度降低,所以可以由a点变到b点,故A正确;
B.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故B错误;
C.在C点表示饱和溶液,在d点表示不饱和溶液,所以Cu(OH)2在c点比在d点代表的溶液中溶解程度大,故C错误;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)?(OH-)3=c(Fe3+)?(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)?(OH-)2=c(Cu2+)?(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D错误;
故选A.
B.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故B错误;
C.在C点表示饱和溶液,在d点表示不饱和溶液,所以Cu(OH)2在c点比在d点代表的溶液中溶解程度大,故C错误;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)?(OH-)3=c(Fe3+)?(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)?(OH-)2=c(Cu2+)?(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D错误;
故选A.
点评:本题考查沉淀溶解平衡、溶度积、pH、水的离子积等知识点,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系;明确坐标点所表达的涵义;对溶度积和水的离子积有正确的理解.

练习册系列答案
相关题目
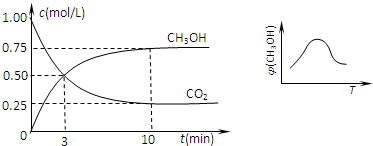 (2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.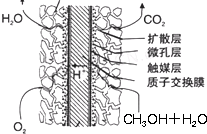
 NH3?H2O+H+
NH3?H2O+H+