题目内容
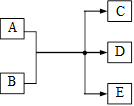
一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的化学方程式是______;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是______;检验C中所含阴离子的实验方法是______.
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.A与B反应的化学方程式是______ CuSO4+SO2↑+2H2O

【答案】分析:(1)若A、C、D均含氯元素,C为氯碱工业的原料,应为NaCl,D溶液具有漂白性,应为NaClO,则A和B的反应为氯气和NaOH的反应;
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸;
(3)二氧化硫的褪色具有可逆性,加热时能恢复到原来的颜色,而NaClO的漂白性不可逆.
解答:解:(1)若A、C、D均含氯元素,C为氯碱工业的原料,应为NaCl,D溶液具有漂白性,应为NaClO,则A和B的反应为氯气和NaOH的反应,
反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,具有强氧化性ClO-,可使KI淀粉溶液显蓝色,说明生成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,检验Cl-,
可利用AgCl不溶于水和硝酸的性质,方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-;
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸,反应的化学方程式为Cu+2H2SO4(浓)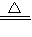 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
amol Cu完全反应生成amolSO2,与NaOH反应可生成NaHSO3和Na2SO3,则所需NaOH的物质的量的范围是a mol≤n(NaOH)≤2a mol,
故答案为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)二氧化硫的褪色具有可逆性,加热时能恢复到原来的颜色,而NaClO的漂白性不可逆,可取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色,
故答案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
点评:本题考查无机物的推断,题目难度较大,本题注意根据常见元素化合物的性质进行推断,解答好本题,具有扎实的基础知识是关键.
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸;
(3)二氧化硫的褪色具有可逆性,加热时能恢复到原来的颜色,而NaClO的漂白性不可逆.
解答:解:(1)若A、C、D均含氯元素,C为氯碱工业的原料,应为NaCl,D溶液具有漂白性,应为NaClO,则A和B的反应为氯气和NaOH的反应,
反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,具有强氧化性ClO-,可使KI淀粉溶液显蓝色,说明生成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,检验Cl-,
可利用AgCl不溶于水和硝酸的性质,方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-;
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸,反应的化学方程式为Cu+2H2SO4(浓)
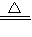 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,amol Cu完全反应生成amolSO2,与NaOH反应可生成NaHSO3和Na2SO3,则所需NaOH的物质的量的范围是a mol≤n(NaOH)≤2a mol,
故答案为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;(3)二氧化硫的褪色具有可逆性,加热时能恢复到原来的颜色,而NaClO的漂白性不可逆,可取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色,
故答案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
点评:本题考查无机物的推断,题目难度较大,本题注意根据常见元素化合物的性质进行推断,解答好本题,具有扎实的基础知识是关键.

练习册系列答案
相关题目
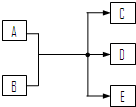
 (2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.
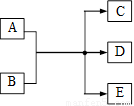
(2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.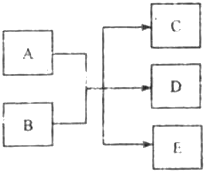 (2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
(2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):