题目内容
7.(1)N元素基态原子的电子排布图为
(2)Fe2+的外围电子排布式为3d6
(3)X元素位于周期表的第ⅢA族,基态X原子有7个轨道填充了电子,则X为Al元素,其价层电子排布式为3s23p1
(4)33号元素的简化电子排布式[Ar]3d104s24p3Cu元素的外围电子排布式3d104s1.
分析 (1)N原子核外有7个电子,分别位于1S、2S、2P轨道;
(2)Fe是26号元素,其原子核外有26个电子,铁原子失去2个电子生成Fe2+,其3d轨道上6个电子为其外围电子;
(3)基态X原子有7个轨道填充了电子,分别是1s、2s、2p、3s、3p轨道,且3p轨道有1个电子,为Al元素,其3s、3p电子为其价电子;
(4)33号元素是As元素,其原子核外有33个电子,根据构造原理书写其简化电子排布式;Cu原子核外有29个电子,其3d、4s电子为其外围电子.
解答 解:(1)N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道表示式为 ,故答案为:
,故答案为: ;
;
(2)Fe是26号元素,其原子核外有26个电子,铁原子失去2个电子生成Fe2+,其3d轨道上6个电子为其外围电子,其价电子排布式为3d6,故答案为:3d6;
(3)基态X原子有7个轨道填充了电子,分别是1s、2s、2p、3s、3p轨道,且3p轨道有1个电子,为Al元素,其3s、3p电子为其价电子,所以其价电子排布式为3s23p1,故答案为:Al;3s23p1;
(4)33号元素是As元素,其原子核外有33个电子,根据构造原理知其简化电子排布式为[Ar]3d104s24p3;Cu原子核外有29个电子,其3d、4s电子为其外围电子,所以其外围电子排布式为3d104s1,故答案为:[Ar]3d104s24p3;3d104s1.
点评 本题考查了原子核外电子排布式的书写,明确原子结构是解本题关键,再结合构造原理来书写即可,知道哪些电子是价电子,为易错点.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
8.已知反应:2NO2(红棕色)?N2O4(无色),分别进行如下两个实验:下列说法不正确的是( )
实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |
15.某有机物甲经氧化后得乙(分子式为C2H3O2Cl),甲经水解后得到丙,1mol丙和2mol乙反应得到含氯的酯(C6H8O4Cl2),由此推断甲的结构简式为( )
| A. | CH2ClCH2OH | B. | HCOOCH2Cl | C. | CH2ClCHO | D. | HOCH2CH2OH |
2.下列实验操作或原理不正确的是( )
| A. | 纸层析法中滤纸所吸附的水作固定相,不与水混溶的有机溶剂作流动相 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
12.工业上制肥皂时,常向皂化反应混合物中加入食盐颗粒,使高级脂肪酸钠析出,这一过程被称为( )
| A. | 蒸馏 | B. | 盐析 | C. | 过滤 | D. | 吸附 |
17.下列叙述正确的是( )
| A. | 将钠放入硫酸铜溶液中可置换出铜 | |
| B. | 铜丝在氯气中燃烧,产生蓝色的烟 | |
| C. | 向氯化铁溶液中滴入KOH溶液,可产生红褐色胶体 | |
| D. | 氢气在氯气中燃烧,火焰呈苍白色 |
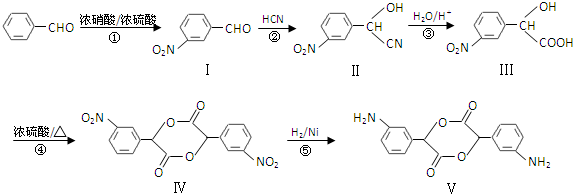
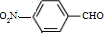 和
和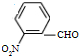 .化合物 I的名称是间硝基苯甲醛.
.化合物 I的名称是间硝基苯甲醛. .(不要求写出反应条件)
.(不要求写出反应条件)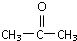 代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为
代替化合物 I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为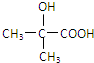 .
.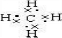 ,食醋中的有机物结构式
,食醋中的有机物结构式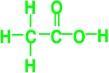 ,糖尿病患者尿液中含的糖类结构简式CH2(OH)CH(OH)CH(OH)CH(OH) CH(OH)CHO.
,糖尿病患者尿液中含的糖类结构简式CH2(OH)CH(OH)CH(OH)CH(OH) CH(OH)CHO.