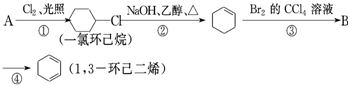
题目内容
(1)氯化铝水溶液呈 性,原因是(用离子方程式表示): ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (用化学式表示)
(2)碳酸钠水溶液呈 性,原因是(用离子方程式表示): ;把碳酸钠溶液蒸干,得到的固体产物是 (用化学式表示)
(3)溴化钠溶液呈 性.
(2)碳酸钠水溶液呈
(3)溴化钠溶液呈
考点:盐类水解的应用,离子方程式的书写
专题:盐类的水解专题
分析:(1)强酸弱碱盐水解显酸性,水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物;
(2)碳酸钠中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性;
(3)溴化钠是强酸强碱盐.
(2)碳酸钠中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显碱性;
(3)溴化钠是强酸强碱盐.
解答:
解:(1)AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:酸; Al3++3H2O?Al(OH)3+3H+;Al2O3;
(2)碳酸钠水溶液中发生CO32-+H2O?HCO3-+OH-,溶液显碱性,由于水解生成强碱氢氧化钠和碳酸氢钠能重新结合生成碳酸钠,所以把碳酸钠溶液蒸干,得到的固体产物是Na2CO3;
故答案为:碱;CO32-+H2O?HCO3-+OH-;Na2CO3;
(3)溴化钠是强酸强碱盐,在溶液中不水解,所以溶液呈中性,故答案为:中.
故答案为:酸; Al3++3H2O?Al(OH)3+3H+;Al2O3;
(2)碳酸钠水溶液中发生CO32-+H2O?HCO3-+OH-,溶液显碱性,由于水解生成强碱氢氧化钠和碳酸氢钠能重新结合生成碳酸钠,所以把碳酸钠溶液蒸干,得到的固体产物是Na2CO3;
故答案为:碱;CO32-+H2O?HCO3-+OH-;Na2CO3;
(3)溴化钠是强酸强碱盐,在溶液中不水解,所以溶液呈中性,故答案为:中.
点评:本题考查盐类水解,明确水解规律即可解答,题目难度不大.

练习册系列答案
相关题目
选用一种试剂就能把浓度为1mol/L的Na2CO3、Na2SO4、Na2SO3、BaCl2溶液加以区别,这种试剂是( )
| A、CaCl2 |
| B、AgNO3 |
| C、NaOH |
| D、H2SO4 |
现有等物质的量的铜和银的混合物17.2g,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是( )
| A、产生的气体是0.2 mol NO2 |
| B、硝酸的物质的量浓度为12 mol?L-1 |
| C、反应中被还原和未被还原的硝酸物质的量之比为3:2 |
| D、要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol |


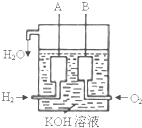 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
 KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.
KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.