��Ŀ����
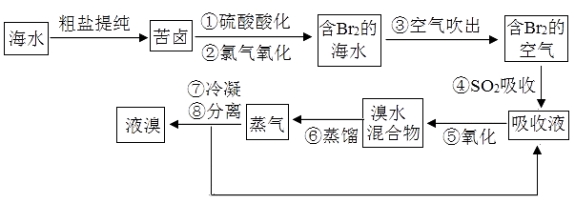
����Ŀ������������������Ŀǰ����ˮ���塱������Ҫ����֮һ���乤���������£�
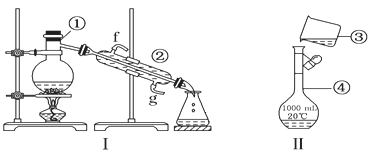
��1�����������������������ʱ��pH��3.5������������Ч����ã���ʹ�þ�ȷpH��ֽ���ܶ�����0.1����ⲽ���������������Һ��pHʱ����������ɫ�仯ʧ������pH���ʧ�ܵ�ԭ���� ��
��2��������з�Ӧ�Ļ�ѧ����ʽΪ ���÷�Ӧ��������SO2�� �ԣ����������ԭ������
��3���������������������õ�Һ������ˮ�Ļ��������ʵ�������÷�Һ©�����з���������ʱ����Һ©���������������� ��
��4������١���֮��δֱ���á���Br2�ĺ�ˮ����������õ�Һ�壬���Ǿ�������������������SO2���ա�����������������������������SO2���ա��������Ĺ���ʵ������һ��Br2�� ���̣���ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ����ͺ� ��
���𰸡���12�֣�ÿ��2�֣�
��1����Һ�е�HClO��pH��ֽƯ������2��SO2+Br2+2H2O=H2SO4+2HBr����ԭ��
��3����ˮ����4��Ũ����������Ч�ʸ�����
��������
������������������������ڹ�ҵ��ģ��ˮ����ij��÷���������һ�ֹ�������Ԥ�Ⱦ����ữ��Ũ����ˮ�У��������û�������ʹ֮��Ϊ�����壬�̶�ͨ�������ˮ���������崵����������ʹ�����������ռ���������������ת�����������Դﵽ������Ŀ�ģ�Ҳ���ǵõ������壮Ȼ�������������������õ���Ʒ�塣��1�����������������������ʱ��pH=3.5������������Ч����ã���ʹ�þ�ȷpH��ֽ���ܶ�����0.1����ⲽ���������������Һ��pHʱ����������ɫ�仯ʧ������pH���ʧ�ܵ�ԭ���ǣ���Һ�е�HClO��pH��ֽƯ�ף���2��Br2��SO2����������ԭ��Ӧ����HBr��H2SO4����Ӧ�ķ��̻�ѧ����ʽΪ��Br2��SO2��2H2O=H2SO4��2HBr����Ӧ�ж�����������Ԫ�ػ��ϼ�+4�����ߵ�+6�ۣ����ֶ�������Ļ�ԭ�ԣ���3���������������������õ�Һ������ˮ�Ļ�����ʵ���ҿ��÷�Һ©�����з��룬Һ���ܶȴ���ˮ������ʱ�ӷ�Һ©�����Ͽڵ���������ˮ����4���Ȼ���ĺ�ˮ��Ȼ�����嵥�ʣ���Ũ�ȵͣ������ͣ�Ӧ����������������SO2���ա��Ȼ����Ĺ��̽��и��������ֱ������ԭ�ϣ���Ʒ�ɱ��ߣ���ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ���Ч�ʸ��ߣ�����ֱ������Br2�ĺ�ˮ����ŵ������ĸ��ٳɱ����ͺ�Ч�ʸ��ߡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�