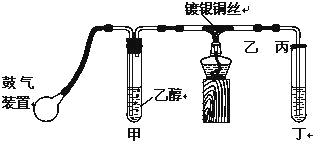
题目内容
【题目】一定温度下,向某密闭容器中充入1.6 molH2与1.0molCO,发生如下可逆反应并达到平衡:H2(g)+CO(g)C(s)+H2O(g)+Q kJ(Q>0).若压缩容器体积并同时升高温度,达到新平衡后,关于下列物理量的变化情况叙述错误的是( )
A.反应速率可能保持不变
B.平衡常数一定减小
C.混合气体的平均摩尔质量可能减小
D.H2O(g)的体积分数可能增大
【答案】AC
【解析】
对于反应H2(g)+CO(g)C(s)+H2O(g)+QkJ(Q>0),正反应为放热反应,升高温度,平衡逆向移动,缩小容器体积即增大压强,平衡正向移动,以此解答该题。
A.升高温度、增大压强,反应速率增大,故A错误;
B.升高温度,平衡逆向移动,平衡常数减小,故B正确;
C.一定温度下,向某密闭容器中充入1.6molH2与1.0molCO,平均摩尔质量为![]() =12g/mol,根据H2(g)+CO(g)C(s)+H2O(g),假设完全反应,则CO反应完全,剩余0.6molH2,生成1molH2O(g),此时气体平均摩尔质量为
=12g/mol,根据H2(g)+CO(g)C(s)+H2O(g),假设完全反应,则CO反应完全,剩余0.6molH2,生成1molH2O(g),此时气体平均摩尔质量为![]() =12g/mol,说明反应前后混合气体的平均摩尔质量不变,所以无论最终平衡向哪个方向移动,混合气体的平均摩尔质量不变,故C错误;
=12g/mol,说明反应前后混合气体的平均摩尔质量不变,所以无论最终平衡向哪个方向移动,混合气体的平均摩尔质量不变,故C错误;
D.如压强影响较大,平衡正向移动,则H2O(g)的体积分数可能增大,故D正确;
故答案选AC。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目