题目内容
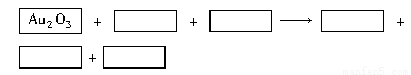
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
(1)Na2S2O3 H2O Na2S4O6 Au2O NaOH (2)Au Na2S2O3
 (4)1:4
(4)1:4
【解析】因为Au2O3为反应物,则Au2O必定为生成物,在Au2O3中Au的化合价为+3价,Au2O中Au的化合价为+1价,即Au在反应中化合价降低,则另一种元素的化合价必定升高,在Na2S2O3中S的化合价为+2价,Na2S4O6中S的化合价为+2.5价,所以Na2S2O3为反应物,Na2S4O6为生成物,根据化合价的升降总值相等,在Na2S4O6前配2,由S守恒,可知Na2S2O3前配4,Au2O3和Au2O前分别配1,再根据Na+守恒,则生成物中必定为NaOH,且配平系数为4,则H2O为反应物,在其前面配2,配平后的化学方程式为:Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH。

练习册系列答案
相关题目