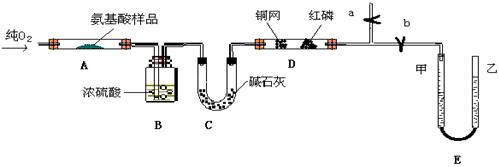
题目内容
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
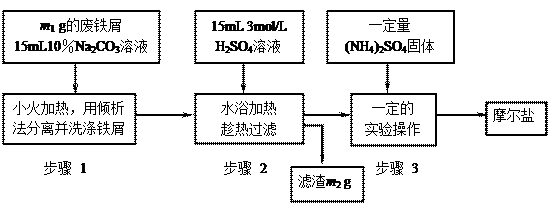
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
(5)抽滤装置的仪器有: ▲ 、 ▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本实验的指示剂 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲ 。
⑤产品中Fe2+的质量分数为 ▲ 。
 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
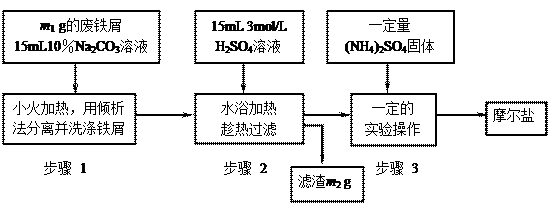
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2
 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。(4)步骤3中,加入(NH4)2SO4固体后,应
 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。(5)抽滤装置的仪器有: ▲ 、 ▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含
 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本实验的指示剂 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲ 。
⑤产品中Fe2+的质量分数为 ▲ 。
 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)(16分,每空1分)(1) CO32— +H2O  HCO3— + OH—
HCO3— + OH—
(2) A、B
(3)Fe + 2Fe3+ = 3Fe2+。防止溶液冷却时,硫酸亚铁因析出而损失。
(4)溶液表面出现晶膜;蒸发浓缩、冷却结晶、干燥。(5)布氏漏斗,抽滤瓶。
(6)5 Fe2++1 MnO4-+( 8H+ ) = 1 Mn2++ 5 Fe3++ 4 H2O
D ,酸式,溶液由无(浅 绿)色变为浅紫色,半分钟内不褪色,14%。
绿)色变为浅紫色,半分钟内不褪色,14%。
(7)a<b<c
 HCO3— + OH—
HCO3— + OH—(2) A、B
(3)Fe + 2Fe3+ = 3Fe2+。防止溶液冷却时,硫酸亚铁因析出而损失。
(4)溶液表面出现晶膜;蒸发浓缩、冷却结晶、干燥。(5)布氏漏斗,抽滤瓶。
(6)5 Fe2++1 MnO4-+( 8H+ ) = 1 Mn2++ 5 Fe3++ 4 H2O
D ,酸式,溶液由无(浅
 绿)色变为浅紫色,半分钟内不褪色,14%。
绿)色变为浅紫色,半分钟内不褪色,14%。(7)a<b<c
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
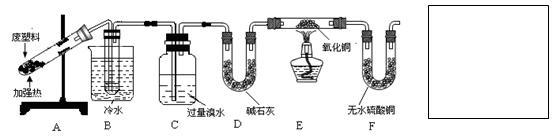
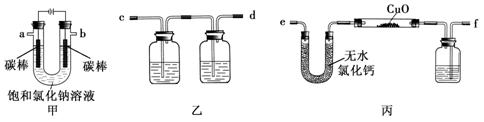
 对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为 。
对硬质玻璃管里的氧化铜粉末加热前,需进行的操作为 。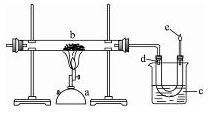
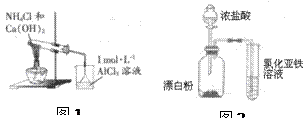
 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。