��Ŀ����
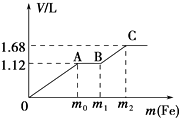
����Ŀ����֪ʵ�����������ķ�Ӧ��Zn+2HCl=ZnCl2+H2��������13.0gZn����һ����2mol/Lϡ�����ַ�Ӧ��һ��ʱ���Zn����ʣ�࣮
��1����˫���Ż����ű������ת�Ƶķ������Ŀ
��2���Ƚ�H+��Zn2+������ǿ��
��3��������������������������
��4������ZnCl2�����ʵ���Ϊ���٣�
��5����״���£�������ռ������������壿
��6����Ӧ��ת�Ƶĵ��ӵĸ�����
���𰸡�
��1��
��2��H+�����Դ���Zn2+
��3��0.2L
��4��0.2mol
��5��4.48L
��6��0.4mol
���������⣺��1��2HCl+Zn�TZnCl2+H2����ʧ���ӵ�ZnԪ�ػ��ϼ����ߣ��õ��ӵ�HԪ�ػ��ϼ۽��ͣ�ZnΪ��ԭ����HClΪ�����������ϼ۽�����Ŀ=���ϼ�������Ŀ=ת�Ƶĵ�����Ŀ=2������ת��������£�  ��
��
���Դ��ǣ�  ��
��
��2����2HCl+Zn�TZnCl2+H2��ZnΪ��ԭ����H+Ϊ������������Zn2+Ϊ������������������������Դ�����������������ԣ���H+�����Դ���Zn2+����H+�����Դ���Zn2+��
��3��5��п��Ħ��������65g/mol������п�����ʵ�����13.0g��65g/mol=0.2mol��
Zn+ | 2 HCl= | ZnCl2 + | H2�� |
1 | 2 | 1 | 1 |
0.2mol | n��HCl�� | n��ZnCl2�� | n��H2�� |
��n��HCl��= ![]() =0.4mol
=0.4mol
n��ZnCl2��=n��H2��= ![]() =0.2mol
=0.2mol
�����������������0.4mol��2mol/L=0.2L
�����Ȼ�п����������0.2mol��
���������ڱ�״���µ�����ǣ�0.2mol��22.4L/mol=4.48L��
�𣺣�3����������������0.2L��
��4�������Ȼ�п��0.2mol��
��5�����������ڱ�״���µ������4.48L��
��6����  ����0.2molZn���뷴Ӧת�Ƶĵ��ӵĸ���Ϊ2��0.2mol=0.4mol���𣺷�Ӧ��ת�Ƶĵ��ӵĸ���Ϊ0.4mol��
����0.2molZn���뷴Ӧת�Ƶĵ��ӵĸ���Ϊ2��0.2mol=0.4mol���𣺷�Ӧ��ת�Ƶĵ��ӵĸ���Ϊ0.4mol��

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�