题目内容
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路板的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
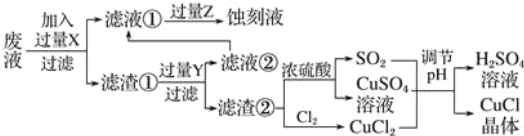
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X ,Y .
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是 ;生产过程中调节溶液的pH不能过大的原因是 ;
(3)写出产生CuCl的化学方程式: .
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是 .
【答案】(1)Fe;(2分)HCl;(2分)
(2)减少产品CuCl的损失;(2分)防止CuCl水解;(2分)
(3)CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;(2分)
(4)防止CuCl的氧化和见光分解(2分)
【解析】
试题分析:(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失。


