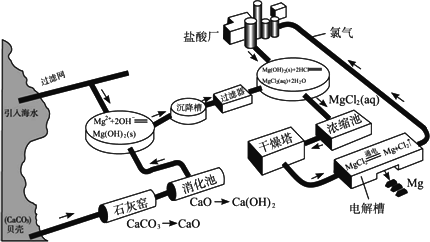
题目内容
下面是海水提镁的流程图:

请回答下列问题:
(1)海水提镁要用到海滩上的贝壳。那么,贝壳在生产流程中起什么作用?
________________________________________________________________________
________________________________________________________________________;
其主要成分发生化学变化的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)从海水中的镁离子到金属镁,经历了哪些化学变化?用离子方程式表示。
(3)在用上述方法提镁的过程中,采用了哪些措施来提高经济效益?
(1)贝壳作为原料之一,分解产生氧化钙,遇水产生氢氧化钙,将镁离子沉淀为氢氧化镁 CaCO3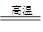 CaO+CO2↑
CaO+CO2↑
(2)海水中的镁离子先与氢氧化钙生成氢氧化镁,氢氧化镁再与盐酸反应生成氯化镁,浓缩干燥得到纯的氯化镁,再加热熔融进行电解即得到金属镁;有关反应:Mg2++2OH-===Mg(OH)2↓,Mg(OH)2+2H+===Mg2++2H2O,Mg2++2Cl-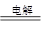 Mg+Cl2↑。
Mg+Cl2↑。
(3)对氯气进行循环利用来提高经济效益。
【解析】
试题分析:海水提镁,最基本的方法就是往海水里加碱,使镁离子转化为氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变成氯化镁,之后经过滤、干燥、电解就可得到金属镁。CaO+H2O===Ca(OH)2,Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2,MgCl2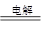 Mg+Cl2↑。用上述方法提镁的过程中,采用了工业常用的循环利用的工艺来提高经济效益,上述方法中循环利用了氯气。
Mg+Cl2↑。用上述方法提镁的过程中,采用了工业常用的循环利用的工艺来提高经济效益,上述方法中循环利用了氯气。
考点:考查金属的提纯、冶炼、方程式的书写以及资源利用等
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中。有利于培养学生的逻辑推理能力,该题把化学知识与实际生产、生活、环境保护及科技前沿等问题结合起来,突出化学与可持续发展、环境保护的密切联系,综合考查学生分析问题、解决问题的能力,较好的体现新课程的理念。